Контрольная работа: Гидролиз солей. Особенности почвенного гидролиза
СА
Подставив (7) в (5), получим
| Кг= | Сн+ * Сон- | = | Кw | (8) |
| К кисл. | К кисл. |
Константа гидролиза равна отношению ионного произведения воды к константе диссоциации слабой кислоты. ![]()
Найдем степень гидролиза соли. Концентрация негидролизованной соли равна СМА (1 - a) ![]() . Негидролизованная соль в разбавленном растворе полностью диссоциирована на ионы и поэтому ее концентрация равна концентрации аниона
. Негидролизованная соль в разбавленном растворе полностью диссоциирована на ионы и поэтому ее концентрация равна концентрации аниона
СМА - = СМА (1 - a). (9)
При гидролизе образуются эквивалентные количества молекул НА и ионов ОН- . Так как мы рассматриваем соль слабой кислоты, то НА диссоциированна в малой степени. Если пренебречь диссоциацией НА, то можно сказать что, Сон - = СНА. Молекула НА образуется из молекулы соли при гидролизе. Если гидролизовано СМА* a молей, то
Сон - = СНА = СМА* a. (10)
Подставив выражения (9) и (10) в уравнение (5), получим
| Кг= | С2 МА* a2 | = | СМА* a2 | (11) |
| С МА* (1-a) | 1-a |
Откуда
СМА* a2 + Кг * a - Кг = 0 и
![]() a= -
a= - ![]() +
+ 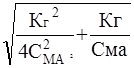
Второй корень уравнения не имеет физического символа, так как a не может быть меньше нуля.
Если степень гидролиза мала (a<< 1), то 1-a» 1 и выражение (11) упрощается
Кг » С МА * a2 ; a»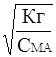 (12)
(12)
Из выражения (12) видно, что увеличение концентрации соли СМА приводит к уменьшению степени гидролиза. Разбавление раствора увеличивает степень гидролиза.
Подставив в уравнение (12) значения Кг из выражения (8), получим
a»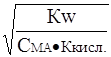 . (13)
. (13)
Сравнение степени гидролиза растворов двух солей одинаковой концентрации дает
a1 »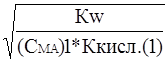 ; a2 »
; a2 »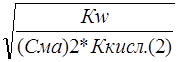 ; и
; и
![]() =
=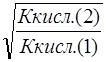 , (14)
, (14)
так как (С МА ) 1 = (С МА ) 2
Степень гидролиза обратно пропорциональна корню квадратному из константы диссоциации слабой кислоты.
Используя выражение (10), можно записать
Сон+ * Сон - = Кw; Сон+ = ![]() =
= ![]()
Подставив сюда ![]() из выражения (13), получим
из выражения (13), получим
Сн+ = 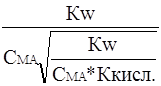 =
= 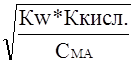 ;
;
После логарифмирования и перемены знаков
lg Сн+ = - ½ lg Кw - ½ lg Ккисл. + ½ lg Сма.
Но - lg Сн + = рН; подобные же обозначения можно употребить и для логарифмов констант равновесия.
Тогда