Контрольная работа: Исследование уравнений реакций
На аноде протекают реакции: Zn0 -2e=Zn2+
На катоде протекают реакции: Ag+ +e=Ag0
Т.к. потенциал Е0 (Ag)> Е0 (Zn)
Е0 (Ag+ |Ag)= +0,80В
Е0 (Zn2+ | Zn)= -0,763В
то на серебряном электроде будет протекать восстановление (будет являться катодом), а на цинковом электроде будет протекать окисление (он будет анодом);
Потенциал гальванического элемента:
Е = Е0 катода – Е0 анода =0,80 – (-0,763)=1,562В
Ответ: 1,562 В.
8. Изделие из алюминия склёпано медью. Какой из металлов будет подвергаться коррозии с водородной деполяризацией, если эти металлы попадут в кислую среду ( HCl )? Составьте уравнения проходящих при этом процессов, приведите схему образующегося гальванического элемента. Определите продукты коррозии
В реакциях с кислотами атомы алюминия окисляются ионами водорода в ионы алюминия, которые переходят в раствор:
2Al+6H+ →2Al3+ +3H2 h
Медь в электрохимическом ряду напряжения металлов находится за водородом, (т.е. её стандартный потенциал положительный) и с разбавленными кислотами не реагирует (положительно заряженные ионы меди не переходят в раствор).
В кристаллической решетке меди (в отличие от алюминия) свободные электроны не накапливаются. При соприкосновении этих двух металлов свободные электроны алюминия переходят к меди и восстанавливают на её поверхность ионы водорода:
2H+ +2e→H2 h
Продуктами коррозии будет являться результат взаимодействия алюминия с соляной кислотой:
2Al+6HCl→2AlCl3 +3H2h
Образуется гальванический элемент:
(–) Al |AlCl3|Cu(+)
Анод катод.
9. При электролизе водных растворов каких из приведённых ниже веществ на катоде выделяется только металл: хлорид бария, хлорид меди ( II ), иодид калия, нитрат серебра, сульфид натрия? Приведите соответствующие уравнения электродных процессов
При электролизе водных растворов катионов металлов, у которых стандартный электродный потенциал больше чем водорода (Е0 >>-0,41В) на катоде восстанавливаются только катионы металлов. В данном случае это хлорид меди (II) и нитрат серебра:
|
(–) Катод
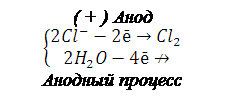
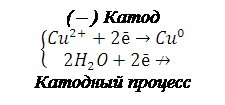
 |
Суммарный процесс электролиза:
![]()
Суммарный процесс электролиза:
![]()
Суммарное молекулярное уравнение электролиза: