Контрольная работа: Количественный анализ
Последний вид титрования основан на использовании различной прочности соединений: определяемое вещество - титрант, «полярографический индикатор» - титрант, образующихся в процессе титрования.
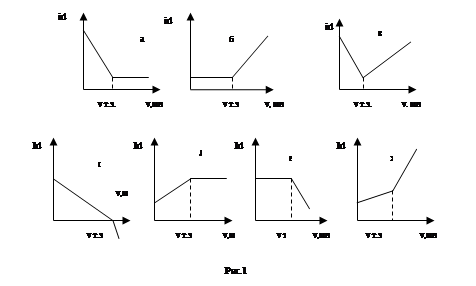
Можно использовать Fe(II) в качестве «полярографического индикатора» при амперометрических титрованиях с ЭДТА. При потенциале +0,4В на платиновом электроде окисляется не Fe(II), а хелат железа (II) с ЭДТА, и, т.о., после достижения точки эквивалентности предельный ток растет. Вид кривой титрования соответствует случаю, изображенному на рис.1 б). Резкий подъем тока наблюдается при рН 4 для большинства ионов металлов, образующих с ЭДТА хелаты, константы, устойчивости которых больше, чем 1018 .
В отдельных, редких случаях можно проводить титрование, когда на поляризуемом (индикаторном) электроде сначала происходит восстановление (или окисление) определяемого вещества, а после момента эквивалентности - титранта. При этом излом на кривой титрования в точке эквивалентности вызван различием в величинах коэффициентов диффузии этих веществ, а также в числе электронов. Примером такого вида титрования может служить определение ванадия (IV) раствором Се(IV). До точки эквивалентности V(IV), взаимодействуя с раствором Ce (IV), переходит в V(V), который, являясь электрохимически активным, восстанавливается на электроде. После момента эквивалентности на электроде протекает восстановление ионов Се(IV). Вид кривой титрования изображен на рис.1

№62
Опишите устройство рН-метра. Охарактеризуйте индикаторный электрод и электрод сравнения, применяемые в рН-метрах.
Решение
Прибор -рН-метр, представляет собой электронный вольтметр с высоким входным сопротивлением или потенциометр с электронным усилителем (вместо гальванометра). В последнем случае усиленный на несколько порядков ток в цепи с исследуемым элементом можно детектировать грубым миллиамперметром.
Для измерения рН используют стеклянный электрод и электрод сравнения (каломельный).
Наиболее распространен стеклянный электрод, который представляет собой тонкостенный шарик из стекла специального состава (напр., 72% SiO2 , 8% СаО, 20% Na2 O), припаянный к стеклянной трубке. Внутрь шарика наливают 0,1 М р-р НСl и погружают в него хлорсеребряный электрод (серебряная проволока в насыщенном растворе AgCl)- внутренний электрод сравнения. Чувствительной к ионам Н+ является только стеклянная мембрана на кончике электрода, которую предварительно хорошо вымачивают в 0,1 М растворе НСl.
Каломельный электрод сравнения изготавливают, используя ртуть и растворы каломели в хлориде калия. Электродная реакция на этом электроде отвечает уравнению: 2Hg + 2Сl-![]() Hg2 Cl2 , а соответствующее уравнение Нернста имеет вид:
Hg2 Cl2 , а соответствующее уравнение Нернста имеет вид:
![]()
где E0 - стандартный потенциал. В зависимости от концентрации КС1 различают насыщенный, нормальный и децинормальный каломельные электроды сравнения. Эти электроды сравнения хорошо воспроизводимы, устойчивы и пригодны для работы при температурах до 80 °С. При более высоких температурах начинается разложение хлоридартути. Часто каломельный электрод сравнения подсоединяют через солевой мостик, состоящий из концентрированного раствора КС1 для снижения диффузионного потенциала. Потенциал Е каломельного электрода сравнения зависит от температуры, причем температурный коэффициент минимален для децинормального электрода, для которого Е =0,3365 - 6 х 10-5 (t-25), где t - температура (°С).
Для измерения рН стеклянный электрод и электрод сравнения погружают сначала в буферный раствор с известным рНст (рН-стандарт) и настраивают рН-метр на величину рН этого раствора. Затем электроды промывают и переносят в исследуемый раствор с рНx ; при этом рНх = рНст + [(Еx - Eст )F/2,303RT], где Ех и Eст -соответствующие потенциалы стеклянного электрода. Для удобства шкалу рН-метра градуируют в единицах рН и снабжают специальным устройством для контроля температуры раствора (чтобы регулировать величину 2,303RT).
Для градуирования стеклянного электрода в качестве рН-стандартов рекомендованы: насыщенный раствор тартрата К, 0,05 М раствор бифталата К, смесь 0,05 М раствора КН2 РО4 и 0,025 М раствора Na2 HPO4 , смесь 0,008695 М раствора КН2 РО3 и 0,03043 М раствора Na2 HPO4 , 0,01 М раствор Na2 B4 O7 . При 25°С величины рН этих Растворов равны 3,56; 4,01; 6,87; 7,41; 9,18 соответственно. Причем рН будет иметь одно и то же значение независимо от того, какой из рН-стандартов был взят при градуировке электрода.
Хотя измеренные рН-метром значения рН равны — lgaHзO + только для очень разбавленных водных растворов, тем не менее эти величины служат полезной характеристикой кислотности растворов, в т.ч. и неводных. При замене воды неводным растворителем увеличивается электрическое сопротивление раствора, становится менее воспроизводимым потенциал электрода, поэтому рекомендуется рассматривать каждый растворитель как независимую систему с собственной шкалой кислотности, протяженность которой определяется величиной константы автопротолиза растворителя.
№73
Охарактеризуйте способы классификации хроматографического анализа
Решение
В основу общепринятых классификаций многочисленных хроматографических методов положены следующие признаки: агрегатное состояние подвижной и не подвижной фаз, механизм взаимодействия сорбент-сорбат, форма слоя сорбента (техника выполнения), цель хроматографирования.
По агрегатному состоянию фаз хроматографию разделяют на газовую и жидкостную. Газовая хроматография включает газожидкостную, жидкостногазотвердофазную, жидкостная – жидкостно-жидкостную, жидкостно-твердофазную и жидкостно-гелевую. Первое слово в названии метода характеризует агрегатное состояние подвижной фазы, второе – неподвижной.
По механизму взаимодействия сорбента и сорбата можно выделить несколько видов хроматографии: распределительная хроматография основана на различии в растворимости разделяемых веществ в неподвижной фазе (газожидкостная хроматография) или на различии в растворимости веществ в подвижной и неподвижной жидких фазах; ионообменная хроматография – на разной способности веществ к ионному обмену; адсорбционная хроматография - на различии в адсорбируемости веществ твердым сорбентом; эксклюзивная хроматография – на различии в размерах и формах молекул разделяемых веществ, аффинная хроматография - на специфических взаимодействиях, характерных для некоторых биологических и биохимических процессов. Существуют пары веществ, реагирующих в растворах с высокой избирательностью, например антитело и антиген, фермент и его субстрат или ингибитор, гормон и соответствующий рецептор, и т.п. Если одно из соединений пары удерживается ковалентной связью на носителе, то последний можно использовать для избирательного извлечения второго соединения пары.
Этими видами не исчерпываются все механизмы разделения, например существует осадочная хроматография , основанная на образовании отличающихся по растворимости осадков разделяемых веществ с сорбентом, адсорбционно-комплексообразовательная , основанная на образовании координационных соединений разной устойчивости в фазе или на поверхности сорбента, и др. Следует помнить, то классификация по механизму весьма условна: ее используют в том случае, если известен доминирующий механизм; часто процесс разделения протекает сразу по нескольким механизмам.
По технике выполнения выделяют колоночную хроматографию, когда разделение проводится в специальных колонках, и плоскостную хроматографию, когда разделение проводится на специальной бумаге(бумажная хроматография) или в тонком слое сорбента (тонкослойная хроматография).
По цели хроматографирования выделяют аналитическую хроматографию (качественный и количественный анализ); препаративную хроматографию (для получения веществ в чистом виде, для концентрирования и выделения микропримесей); промышленную (производственную) хроматографию для автоматического управления процессом (при этом целевой продукт из колонки поступает в датчик). Хроматографию широко используют для исследования растворов, каталитических процессов, кинетики химических процессов и т.п.
№49
Для определения содержания меди в латуни навеску последней в 0,1435 г растворили и после соответствующей обработки довели объем раствора до 50 мл. При снятии полярограммы полученного раствора высота волны оказалась равной 28 мм. Определите процентное содержание меди в анализируемом образце. Калибровочный график постройте по условию:
| Cu2+ ∙ 10-3 | 0,5 | 1,0 | 1,5 | 2,0 |
| h, мм | 5,0 | 15,0 | 25,0 | 35,0 |
Дано: Найти: W(Cu)= ?%
m(навески) =0,1435 г