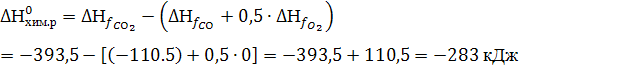Контрольная работа: Окислительно-восстановительные реакции органических веществ
Окислитель: HNO2
Данная окислительно-восстановительная реакция относится к реакциям диспропорционирования, т.к. молекулы одного и того же вещества (HNO2 ) способны окислять и восстанавливать друг друга. Это происходит потому, что вещество HNO2 содержит в своем составе атомы азота в промежуточной степени окисления (3+). Следовательно, степень окисления способна как понижаться, так и повышаться.
| Окисление: | NO2 - + H2 O‒2e- →NO3 - + 2H+ | 1 |
| Восстановление: | NO2 - + 2H+ + e- →NO + H2 O | 2 |
3NO2 - + H2 O + 4H+ → NO3 - + 2H+ + 2NO + 2H2 O 3NO2 - + 2H+ → NO3 - + 2NO + H2 O | ||
№62:
NH3 + KMnO4 + KOH = KCl + K2 MnO4 + H2 O
Некорректное условие – ошибка в реагентах (NH3 ) и продуктах реакции (KCl). Возможное правильное условие:
KCl + 8KMnO4 + 8KOH = KClO4 + 8K2 MnO4 + 4H2 O
Восстановитель: KCl
Окислитель: KMnO4
| Окисление: | Cl- + 8OH- ‒ 8e- → ClO4- + 4H2O | 1 |
| Восстановление: | MnO4- + e- → MnO42- | 8 |
| Cl- + 8OH- + 8MnO4- → ClO4- + 4H2O + 8MnO42- | ||
143. При сгорании 1 л бутана С4 Н10 выделилось 119,1 кДж теплоты. Вычислить энтальпию образования бутана. Условия нормальные.
Решение:
Уравнение реакции:
![]()
![]() ;
;
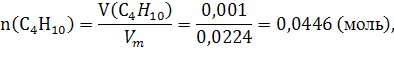
При сгорании ![]()
![]() выделяется
выделяется ![]() теплоты, а при сгорании
теплоты, а при сгорании ![]()
![]() –
– ![]() теплоты, тогда
теплоты, тогда
119,2/2=x/0,0446;
x=2,65 (кДж).
Ответ: выделится ![]() .
.
162. Возможно ли при 2000 С протекание следующей реакции:
СО + 0,5О2 = СО2 ?
Решение:
Возможно ли при 2000 С протекание следующей реакции: СО + 0,5О2 = СО2 ?
О принципиальной возможности и направлении процесса позволяют судить величина и знак ΔG (энергия Гиббса).
ΔG = ΔH – TΔS,
![]()
![]() где ΔH – изменение энтальпии реакции; ΔS – изменение энтропии реакции; Т – температура.
где ΔH – изменение энтальпии реакции; ΔS – изменение энтропии реакции; Т – температура.
![]() - стандартная энтальпия образования вещества
- стандартная энтальпия образования вещества
- стандартная энтропия образования вещества
п - количество вещества
| СО (газ) | О2 (газ) | СО2 (газ) | |
| -110,5 | 0 | -393,5 | |
| 197,9 | 205 | 213,6 |