Контрольная работа: Основні проблеми хімічної кінетики
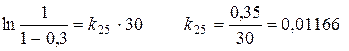 1/хв.
1/хв.
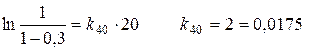 1/хв.
1/хв.
Енергію активації знаходимо з рівняння Ареніуса:
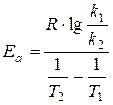 (8)
(8)
де R - універсальна газова постійна (8,31) ![]()
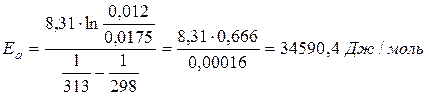
Відповідь: Енергія активації дорівнює 34,6 кдж/ моль
Задача 4
Дослідження активності радіоактивного препарату показало, що за 10 днів активність його зменшилася на 8,5%. Визначити константу швидкості реакції і час, протягом якого він розкладеться на 75%., якщо реакція розкладання має перший порядок.
Рішення:
Припускаючи, що розкладання йде по мономолекулярному закону
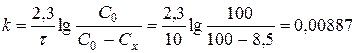 дня -1
дня -1
Час, протягом якого препарат розкладеться на 75%, визначаємо з рівняння константи швидкості реакції, у якому С х =75
 дня
дня
Відповідь: Константа швидкості реакції дорівнює3,7∙ 104 година -1 ; 75% препарату розкладеться протягом 259 днів.
Задача 5
В скільки разів збільшиться швидкість розчинення заліза в соляній кислоті при підвищенні температури з 25 до 350 С, якщо температурний коефіцієнт швидкості розчинення  дорівнює 2,8.
дорівнює 2,8.
Рішення:
 (9)
(9)
 рази
рази
Задача 6
На підставі експериментальних даних побудувати кінетичні криві, розрахувати енергію активації і підібрати рівняння для топохімічної реакції, що характеризує кінетику перетворення, використовуючи моделі рівнянь, запропоновані Гістлінгом.
хімічна адсорбція кінетика реакція
Таблиця 1.
Експериментальні дані
| Час, τ мін. | Ступінь перетворення, частки одиниці, Т=3000 С | Ступінь перетворення, частки одиниці, Т=3500 С |
| 0 | 0 | 0 |
| 1 | 0,215 | 0, 196 |
| 2 | 0,489 | 0,461 |
| 3 | 0,672 | 0,705 |
| 4 | 0,85 | 0,949 |
| 5 | 0,946 | 0,985 |
| 6 | 0,97 | 0,992 |
| 7 | 0,983 | 0,996 |
| 8 | 0,991 | 0,998 |
| 9 | 0,992 | 0,999 |
| 10 | 0,995 | 1 |
Для рішення задачі скористаємося рівняннями Гінстлінга, що характеризують кінетику перетворень у сумішах твердих речовин і які дозволяють одержувати результати, у достатній мірі наближені до реальних. Ці рівняння виведені для наступних спрощених умов:
1) анізотропія компонентів реакційної суміші не впливає на кінетику процесу;
2) зерна реагентів практично рівновеликі, а форма їх близька до правильної (кульової або кубічної);
3) швидкість процесу не лімітується теплообміном між реагуючими речовинами і навколишнім середовищем і не залежить від швидкості плавлення або кристалізації;
4) масопередача здійснюється в результаті руху часток лише одного компонента (унаслідок великого розходження в рухливості часток реагентів);
5) шар твердого продукту реакції відділений від реагуючого компонента різкою границею;
6) процес квазістаціонарний, саморегулюючий - швидкість усіх його стадій залежить від швидкості самої повільної з них.