Контрольная работа: Особенности преподавания химии на примере темы "Водород"
Ответы учащихся, демонстрация опыта. (Приложение 1, слайд № 13)
Учитель: Кислоты вступают в химическую реакцию с металлами и их оксидами. Дописать уравнения химических реакций, определить тип химической реакции.
Самостоятельная работа учащихся в тетрадях. (Приложение 1, слайд № 14)
Учитель: Какое вещество образовалось в результате взаимодействия металла с кислотой?
Ответы учащихся. (Приложение 1, слайд № 15)
Выбрать формулы солей, затем кислот и оксидов. Дать им названия. (Приложение 1, слайд № 16)
Учитель: Как дают названия солям? Составить формулы солей.
Ответы учащихся. (Приложение 1, слайд № 17)
Скоростная дорожка «Дать названия солям» (работа выполняется на время)
Разноуровневая самостоятельная работа. Учащиеся имеют право выбора задания (Приложение 2).
Решение задачи по уравнению химической реакции в двух вариантах ( стр.78 № 10, 11 по учебнику Е.Е. Минченкова, 8 класс).
V. Домашнее задание: стр. 77, № 5, 6 учебника Е.Е.Минченкова, 8 класс.
VI. Подводятся итоги урока, выставляются оценки.
– Я довольна вашей работой, но моей оценки недостаточно, ответьте пожалуйста на следующие вопросы: (Приложение 1, слайд № 18)
– Спасибо за внимание. (Приложение 1, слайд № 19)
г) Водород (вещество)
При обычных условиях водород – газ без цвета и запаха. В небольших количествах он нетоксичен. Твердый водород плавится при 14 К (–259 °С), а жидкий водород кипит при 20 К (–253 °С). Низкие температуры плавления и кипения, очень маленький температурный интервал существования жидкого водорода (всего 6 °С), а также небольшие значения молярных теплот плавления (0,117 кДж/моль) и парообразования (0,903 кДж/моль) говорят о том, что межмолекулярные связи в водороде очень слабые. Плотность водорода r(Н2) = (2 г/моль):(22,4 л/моль) = 0,0893 г/л. Для сравнения: средняя плотность воздуха равна 1,29 г/л. То есть водород в 14,5 раза "легче"воздуха. В воде он практически нерастворим. При комнатной температуре водород малоактивен, но при нагревании реагирует со многими веществами. В этих реакциях атомы водорода могут как повышать, так и понижать свою степень окисления: Н2 + 2е– = 2Н–I, Н2 – 2е– = 2Н+I.
В первом случае водород является окислителем, например, в реакциях с натрием или с кальцием: 2Na + H2 = 2NaH, (t) Ca + H2 = CaH2. (t) Но более характерны для водорода восстановительные свойства: O2 + 2H2 = 2H2O, (t)
CuO + H2 = Cu + H2O. (t)
При нагревании водород окисляется не только кислородом, но и некоторыми другими неметаллами, например, фтором, хлором, серой и даже азотом. В лаборатории водород получают в результате реакции
Zn + H2SO4 = ZnSO4 + H2![]() .
.
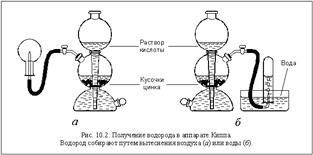
Вместо цинка можно использовать железо, алюминий и некоторые другие металлы, а вместо серной кислоты – некоторые другие разбавленные кислоты. Образующийся водород собирают в пробирку методом вытеснения воды (см. рис. 10.2 б) или просто в перевернутую колбу (рис. 10.2 а).
В промышленности в больших количествах водород получают из природного газа (в основном это метан) при взаимодействии его с парами воды при 800 °С в присутствии никелевого катализатора:
CH4 + 2H2 O = 4H2 +CO2 (t, Ni)
или обрабатывают при высокой температуре парами воды уголь:
2H2 O + С = 2H2 + CO2 . (t)
Чистый водород получают из воды, разлагая ее электрическим током (подвергая электролизу):
2H2 O = 2H2 ![]() + O2
+ O2 ![]() (электролиз).
(электролиз).