Контрольная работа: Растворение твердых веществ
Если сравнить скорость растворения при равных значениях ![]() , то
, то ![]() и
и ![]() (т.к. начальные концентрации одинаковы исходя из начально заданных условий, а изменение концентрации в ходе растворения стехиометрически связано с долей растворившегося продукта). Поэтому для равных значений
(т.к. начальные концентрации одинаковы исходя из начально заданных условий, а изменение концентрации в ходе растворения стехиометрически связано с долей растворившегося продукта). Поэтому для равных значений ![]() можно записать:
можно записать:
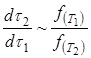 (13)
(13)
Отношение, стоящее в правой части уравнения (13), не зависит от времени.
Интегрируя это уравнение и подставляя вместо ![]() и
и ![]() их значения, равные
их значения, равные ![]() и
и ![]() , получим окончательно:
, получим окончательно:
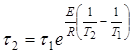 (14)
(14)
Необходимо подчеркнуть, что ![]() и
и ![]() означают время, необходимое для достижения одного и того же значения
означают время, необходимое для достижения одного и того же значения ![]() в первом и втором опытах.
в первом и втором опытах.
Уравнение (14) показывает, что зависимость ![]() от
от ![]() выражается аппроксимирующей линией, тангенс угла наклона которой к оси абсцисс численно равен энергии активации Е/R.
выражается аппроксимирующей линией, тангенс угла наклона которой к оси абсцисс численно равен энергии активации Е/R.
Вместо определения углового коэффициента прямой, энергию активации можно вычислить по формуле:
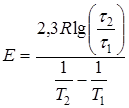 (15)
(15)
Вычисления по формуле (15) в других интервалах ![]() дадут набор значений Е, из которого легко получить наиболее достоверное (среднее) значение энергии активации и среднюю ошибку её определения, которая не должна быть более 10%. В противном случае необходимо искать ошибку в постановке эксперимента или в расчетах. Возможно также изменение механизма процесса растворения. В последнем случае необходимо сузить температурные интервалы и увеличить количество экспериментов.
дадут набор значений Е, из которого легко получить наиболее достоверное (среднее) значение энергии активации и среднюю ошибку её определения, которая не должна быть более 10%. В противном случае необходимо искать ошибку в постановке эксперимента или в расчетах. Возможно также изменение механизма процесса растворения. В последнем случае необходимо сузить температурные интервалы и увеличить количество экспериментов.
2.2 Определение порядка реакции
химический процесс растворение
Для определения порядка реакции нужно провести не менее двух периодических опытов при одной и той же температуре, но при различных начальных концентрациях активного реагента ![]() ≠
≠![]() . В этих опытах определяют зависимости доли нерастворившегося компонента от продолжительности растворения
. В этих опытах определяют зависимости доли нерастворившегося компонента от продолжительности растворения ![]() и
и ![]() . Кроме того, необходима информация об изменении концентрации активного реагента в ходе растворения, т.е. зависимости
. Кроме того, необходима информация об изменении концентрации активного реагента в ходе растворения, т.е. зависимости ![]() и
и ![]() , где
, где ![]() и
и ![]() - текущие концентрации активного реагента в первом и втором опытах. Эти зависимости могут быть получены либо прямыми измерениями (в тех же опытах), либо расчетным путем, исходя из стехиометрических соотношений. При этом необходимо учитывать, что данные полученные расчетным путем дают, как правило большую ошибку, чем экспериментальные данные (при условии грамотной постановки эксперимента). Затем по экспериментальным данным строят зависимость
- текущие концентрации активного реагента в первом и втором опытах. Эти зависимости могут быть получены либо прямыми измерениями (в тех же опытах), либо расчетным путем, исходя из стехиометрических соотношений. При этом необходимо учитывать, что данные полученные расчетным путем дают, как правило большую ошибку, чем экспериментальные данные (при условии грамотной постановки эксперимента). Затем по экспериментальным данным строят зависимость ![]() от
от ![]() , где
, где ![]() и
и ![]() отвечают равным значениям
отвечают равным значениям ![]() и
и ![]() . Из уравнений для скорости растворения (12) при равных значениях
. Из уравнений для скорости растворения (12) при равных значениях ![]() следует соотношение:
следует соотношение:
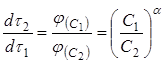 (16)
(16)
откуда
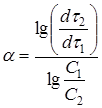 (16а)
(16а)
Уравнение (16) относится к произвольному, но фиксированному значению ![]() . Отношение приращений
. Отношение приращений ![]() и текущие концентрации активного реагента
и текущие концентрации активного реагента ![]() и
и ![]() должны быть определены в точках, отвечающих этим значениям. Как и в случае определения энергии активации по уравнениям (14) и (15) вычисления по уравнению (16) или (16а) можно выполнить для целого ряда значений
должны быть определены в точках, отвечающих этим значениям. Как и в случае определения энергии активации по уравнениям (14) и (15) вычисления по уравнению (16) или (16а) можно выполнить для целого ряда значений ![]() и за тем усреднить полученные результаты. При этом необходимо помнить, что расхождения результатов параллельных изменений не должны превышать 10%.
и за тем усреднить полученные результаты. При этом необходимо помнить, что расхождения результатов параллельных изменений не должны превышать 10%.
Из изложенного выше следует, что определение порядка реакции много сложнее чем определение энергии активации, так как требует численного или графического дифференцирования полученной из опытов зависимости ![]() . Причина этого усложнения ясна: концентрация активного реагента в периодическом опыте, как правило, может изменяться в больших интервалах. В тоже время температуру в ходе опыта можно легко поддерживать постоянной, в пределах
. Причина этого усложнения ясна: концентрация активного реагента в периодическом опыте, как правило, может изменяться в больших интервалах. В тоже время температуру в ходе опыта можно легко поддерживать постоянной, в пределах ![]() . Определение порядка реакции можно упростить, если концентрацию активного реагента в ходе периодического опыта не изменять. Это достигается путем восполнения убыли реагента в ходе растворения (периодическое дозирование), или сделать это изменение пренебрежимо малым, проводя опыт с очень большим избытком активного реагента. Этого можно достичь предварительным расчетом, чтобы даже при полном растворении твердого растворяющегося вещества, концентрация растворителя не снизилась более, чем на 5-10% от исходной. Во всех выше описанных случаях правая часть уравнения (16) или (16а) должна являться постоянной величиной, поэтому
. Определение порядка реакции можно упростить, если концентрацию активного реагента в ходе периодического опыта не изменять. Это достигается путем восполнения убыли реагента в ходе растворения (периодическое дозирование), или сделать это изменение пренебрежимо малым, проводя опыт с очень большим избытком активного реагента. Этого можно достичь предварительным расчетом, чтобы даже при полном растворении твердого растворяющегося вещества, концентрация растворителя не снизилась более, чем на 5-10% от исходной. Во всех выше описанных случаях правая часть уравнения (16) или (16а) должна являться постоянной величиной, поэтому 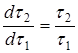 , и зависимость
, и зависимость ![]() является линейной.
является линейной.
Поэтому необходимость в дифференцировании отпадает, и расчетная формула для ![]() принимает вид:
принимает вид:
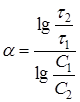 (17)
(17)
причем ![]() и
и ![]() - теперь уже постоянные величины.
- теперь уже постоянные величины.
2.3 Определение кинетической функции
Для описания растворения необходима кинетическая характеристика процесса растворения. Выразим время в безразмерных единицах – в долях времени полного растворения ![]() . Безразмерное время, равное отношению продолжительности растворения
. Безразмерное время, равное отношению продолжительности растворения ![]() к времени полного растворения
к времени полного растворения ![]() , обозначим через х:
, обозначим через х:
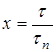 .
.
В качестве кинетической характеристики процесса удобно использовать зависимость доли нерастворившегося компонента ![]() от безразмерного времени х при постоянных концентрациях и температуре. Зависимость
от безразмерного времени х при постоянных концентрациях и температуре. Зависимость ![]() называется кинетической функцией.
называется кинетической функцией.
Результаты периодического опыта дают зависимость доли нерастворившегося продукта ![]() от времени
от времени ![]() , для получения кинетической функции
, для получения кинетической функции ![]() достаточно выразить время в безразмерных единицах
достаточно выразить время в безразмерных единицах 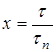 , причем время полного растворения
, причем время полного растворения ![]() определяют в том же опыте.
определяют в том же опыте.
Подобный способ с известным приближением можно применять в тех случаях, когда изменения концентрации активного реагента в ходе растворения малы (например при большом избытке активного реагента).
Для определения кинетической функции могут быть использованы результаты любого периодического опыта, проведенного при постоянных значениях концентрации активного реагента и температуры. Методика определения сводиться к следующему.
1. Результаты периодического опыта представляют в виде зависимостей доли нерастворившегося компонента ![]() и концентрации активного реагента
и концентрации активного реагента ![]() от времени
от времени ![]() :
: ![]() и
и ![]() .
.