Контрольная работа: Равновесный состав газа в металлургических реакциях
Министерство образования и науки Российской Федерации
Федеральное агентство по образованию
Государственное образовательное учреждение высшего профессионального образования
Магнитогорский государственный технический университет им. Г.И.Носова
Контрольная работа по дисциплине "Физическая химия металлургических процессов"
"Равновесный состав газа в металлургических реакциях"
Магнитогорск, 2010
Задача №1
Для реакции водяного газа
CO + H2O = CO2 + H2
Определить возможное направление реакции и равновесный состав газа при температурах :
t = 700° C
t2 = 800° C
t3 = 900° C
t4 = 1000° C
если исходная газовая смесь содержит 23% СО и 27% H2O, 20% CO2 и 30% H2.
Решение:
Равновесный состав газа в реакции водного газа
CO + H2O = CO2 + H2
Данная реакция имеет место во многих процессах горения топлива, определяя в значительной степени состав газа в доменной печи при взаимодействиях водяного пара с коксом при мокром и сухом тушении.
Равновесие реакции количественно характеризуется константой равновесия:
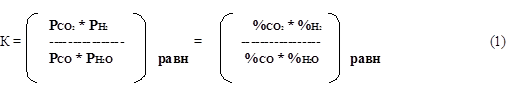
Данная система трехкомпонентная и однофазная, поэтому
C = k – f + n = 3 – 1 + 1 = 3
Значит, равновесный состав газа зависит от трех факторов: температуры Т и 2-х исходных концентраций.
Константа равновесия реакции может быть рассчитана по эмпирическому уравнению:

По условию задачи известен исходный состав газа:
23% CO
27% H2O
Значит, в 100 моль исходного газа содержалось такое же количество моль каждого компонента:
ni = %i
Допустим, что при некоторой температуре t° C реакция возможна в прямом направлении и к моменту достижения равновесия прореагирует Х моль СО с Х моль H2O и появилось Х моль H2 и Х моль СО2. Тогда при равновесии количества молей газов ( об.%)
(23-Х) моль СО (27-Х) моль H2O
(20+Х) моль СО2 (30+Х) моль H2
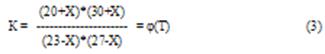
Решая уравнение (3) относительно Х при различных температурах, получаем два значения корня уравнения (3), приведенных в таблице 1.
Таблица 1.
| t° C | Кр | Х1 моль | Х2 моль | % СО | % H2O | % CO2 | % H2. |
| 700 | 1,645 | 3,24 | 202 | 19,8 | 23,7 | 23,2 | 33,2 |
| 800 | 1,080 | 0,67 | 1322 | 22,3 | 26,3 | 20,7 | 30,7 |
| 900 | 0,760 | -1,46 | -365 | 24,5 | 28,5 | 18,5 | 28,5 |
| 1000 | 0,566 | -3,23 | -177 | 26,2 | 30,2 | 16,8 | 26,2 |
--> ЧИТАТЬ ПОЛНОСТЬЮ <--