Контрольная работа: Синтез аміаку
R - універсальна газова постійна;
k1,0 і k2,0 - константи.
З вираження закону Ареніуса видно, що з ростом температури константи швидкості швидко зростають. Константи швидкості прямій і зворотної реакції зв'язані певним співвідношенням з константою рівноваги:
![]() (5)
(5)
де Кр - константа рівноваги синтезу аміаку.
Залежність константи рівноваги від температури в першому наближенні виражається законом Вант-Гоффа:
![]() (6)
(6)
де ΔН - теплота реакції синтезу при температурі Т.
При низьких температурах константа швидкості зворотної реакції зменшується значно швидше константи швидкості прямої реакції. При цьому швидкість зворотної реакції стає багато менше швидкості прямої реакції і її можна не враховувати, тому в області низьких температур підвищення температури приводить до збільшення швидкості реакції. Навпаки, в області температур, близьких до рівноважної температури, швидкість зворотної реакції становить значну частину швидкості прямої реакції. Тут більше швидкий ріст зворотної реакції з температурою в порівнянні із прямої приводить до того, що з підвищенням температури загальна швидкість реакції падає. Оптимальну температуру визначає така характеристика каталізатора, як енергія активації зворотної реакції Е2. Для каталізаторів різної активності оптимальні температури однакові при одній і тій же енергії активації.
Оптимальна температура залежить від складу реакційної суміші. Зі збільшенням змісту аміаку й зменшенням змісту азоту й водню оптимальна температура зменшується. Чім глибше пройшла реакція, тим більше ступінь перетворення, і тим менше оптимальна температура.
Низькому змісту аміаку відповідає висока оптимальна температура, що може перевищити максимально припустиму температуру каталізатора.
1.5 Співвідношення реагентів
Із загальних міркувань, а, також з аналізу рівняння Тьомкіна-Пижева витікає, що коли зміст якого-небудь реагенту (водню або азоту) наближається до нульового або стовідсоткового, в обох випадках швидкість реакції прагне до нуля. Існує оптимальне співвідношення водню й азоту, при якому швидкість реакції максимальна.
Відповідно до термодинамічних розрахунків максимальний вихід аміаку при високих тисках повинен спостерігатися для співвідношення РН2:РN2 трохи менше 3:1. В умовах промислового каталітичного синтезу такий вихід досягається при відношенні РH2:РN2 близьким до 3. Зрушення максимуму убік суміші, збагаченої азотом, у випадку каталітичного процесу може бути пояснений тим, що стадією, що лімітує, процесу в широкому інтервалі умов є активована адсорбція азоту. При використанні сумішей, збагачених воднем, протікання процесу на каталізаторі при тиску 30 МПа й низьких температурах (350°С) характеризується гальмуючим впливом водню на каталізаторах, промотованих тільки оксидом алюмінію (від 2 до 15% А12О3). Ступінь наближення до рівноваги тим менше, чим вище концентрація А12О3, нижче температура.
Аналіз кінетичних залежностей синтезу аміаку дозволяє зробити наступні висновки:
- ефективність процесу збільшується з ростом тиску, об'ємної швидкості й зменшенням початкового змісту аміаку й інертів;
- існує оптимальний температурний режим процесу, що є “падаючим”, тобто зі збільшенням змісту аміаку оптимальна температура зменшується;
- існує оптимальне співвідношення водню й азоту, що при низьких змістах аміаку становить 1,5, а при близьких до рівноважного - 3,0.
2. Практична частина
2.1 Завдання 1
Скільки виділиться теплоти при синтезі аміаку (на 1000 кг продукту) і наскільки підвищилася б температура газу на виході із шару каталізатора, якби процес був адіабатичним? Синтез проводять при тиску 300 атм, температура газу на вході в колону 4500С, температура синтезу 5000С. Зміст аміаку у газовій суміші, що надходить у колону 4 % про., у вихідній 16% об.
Рішення:
Кількість теплоти виділяється на 1 кмоль аміаку залежно від температури й тиску процесу синтезу розраховують по формулі:
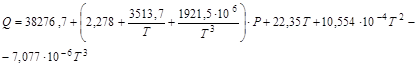
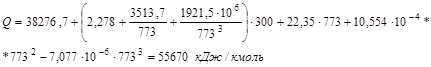
де Т - температура синтезу, К;
Р - тиск синтезу, атм.
На 1000 кг аміаку виділиться наступна кількість теплоти:
![]()
Кількість синтез-газ, що надходить у колону на 1000 кг аміаку дорівнює: