Контрольная работа: Синтез аміаку
азоту: 0,11 + 0,17/2 = 0,195 моль
водню: 0,72 + 0,225 = 0,975 моль моль
разом 1,17 моль
або
азоту: 0,195/1,17*100 = 16,7% про.
водню: 0,975/1,17*100 = 83,3% про.
Співвідношення N2 : H2 у вихідній суміші 16,7 6 83,3 = 1:5
2.3 Завдання 3
Для процесу синтезу аміаку розрахувати рівноважний вихід аміаку й величину константи рівноваги ![]() при температурі t1 = 6000С. Процес здійснюється під тиском Р = 3*107 Па (300 атм). Вихідна суміш містить реагенти в стехіометричному співвідношенні.
при температурі t1 = 6000С. Процес здійснюється під тиском Р = 3*107 Па (300 атм). Вихідна суміш містить реагенти в стехіометричному співвідношенні.
Рішення:
Рівняння реакції синтезу аміаку:
N2 + 3H2 = 2 NH3
або
1/2N2 + 3/2H2 = NH3
При температурі Т и тиску Р визначимо парціальні тиски компонентів у газовій суміші, позначивши через Хр – рівноважний зміст NH3 у газі:
![]()
Підставивши значення парціальних тисків у вираження, що визначає Кр, одержимо:
![]()
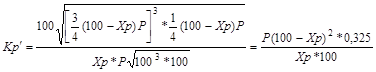
![]()
Позначивши![]() , одержимо квадратне рівняння
, одержимо квадратне рівняння
![]()
![]()
По рівнянню Ларсона й Доджа, що визначає взаємозв'язок між константою рівноваги, коефіцієнтом β і постійної інтегрування I при різних тисках
![]()
де β - поправочний коефіцієнт на тиск
підставивши відповідні значення βі I з довідкових даних, одержимо:
Р, атβI
1001,256*10-4-2,113