Контрольная работа: Создание безотходной технологии в производстве кальцинированной соды
![]() ,
,
который затем гидролизуется
![]()
с образованием пересыщенного по НСО3 – раствора. Затем из пересыщенного раствора кристаллизуется гидрокарбонат натрия, образующийся по реакции:
![]()
Кристаллизация гидрокарбоната натрия подчиняется общим закономерностям и зависит, прежде всего, от температуры, пересыщения и скорости перемешивания раствора. Необходимо отметить, приведенная схема только условно отображает процесс.
Процесс насыщения аммонизированного рассола диоксидом углерода является экзотермическим. Поэтому выделяющееся тепло необходимо отвести, чтобы обеспечить требуемые степени карбонизации раствора и утилизации натрия.
Наиболее простое кинетическое уравнение процесса карбонизации имеет вид:
![]()
где ![]() – количество диоксида углерода, поглощенного в единицу времени единицей поверхности раствора, моль/м3 ;
– количество диоксида углерода, поглощенного в единицу времени единицей поверхности раствора, моль/м3 ;
![]() – концентрация активного компонента (не связанного в хлорид и углеаммонийные соли аммиака), н.д.;
– концентрация активного компонента (не связанного в хлорид и углеаммонийные соли аммиака), н.д.;
![]() – константа, включающая константу Генри и частичный коэффициент абсорбции для жидкостной пленки;
– константа, включающая константу Генри и частичный коэффициент абсорбции для жидкостной пленки;
![]() – давление диоксида углерода над метастабильным раствором, кПа;
– давление диоксида углерода над метастабильным раствором, кПа;
![]() – парциальное давление CO2 в карбонизующем газе, кПа.
– парциальное давление CO2 в карбонизующем газе, кПа.
Следует отметить, что температурный режим влияет на процесс образования кристаллов NaHCO3 . Для получения крупных кристаллов правильной формы, которые не забивают поверхность вакуум-фильтров и малорастворимые в процессе фильтрации, необходимо поддерживать температуру 60–72 °С в зоне образования и в начальных период роста кристаллов. В процессе дальнейшего роста кристаллов температура уже не оказывает существенного влияния на рост кристаллов. При нормальном росте кристаллов образуются кристаллы типа "бочка", при ухудшении процесса кристаллизации образуются длинные кристаллы склонные к образованию сростков в виде снопов – кристаллы "друза". Такие кристаллы забивают вакуум-фильтры и способствуют тому, что в осадке гидрокарбонат натрия содержится больше воды, чем в кристаллах типа "бочка".
На основе горизонтальной проекции изотермической диаграммы растворимости для 15 °С в системе NaCl–NH4 Cl–NH4 HCO3 –NaHCO3 , изученной П.П. Федотьевым (см. рис. 1.1), можно определить оптимальные условия для проведения процесса карбонизации [6]. Они находятся вблизи точки Р1 и линии P1 –IV.
Выпавший осадок гидрокарбоната натрия отфильтровывают, и далее его подвергают прокаливанию с получением соды (уравнение 1.5). Температура разложения гидрокарбоната натрия составляет 160–180 °С. Эта операция протекает в отделении кальцинации. Выделяющийся диоксид углерода используется в процессе карбонизации.
I–Р2 – растворы, насыщенные NaHCO3 и NaCl; P2 –P1 – растворы, насыщенные NaHCO3 и NaCl; P1 –IV – растворы, насыщенные NaHCO3 и NH4 HCO3 ;
P1 – раствор, насыщенный NaHCO3 , NH4 HCO3 и NH4 Cl; Р2 – раствор, насыщенный NaCl, NH4 C1 и NaHCO3 .
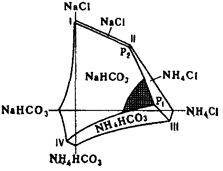
Рис. 1.1 – Диаграмма системы NaCl–NH4 Cl–NH4 HCO3 –NaHCO3
Аммиак обычно регенерируют из хлорида аммония и возвращают в производство. С этой целью раствор, содержащий хлорид аммония подвергают обработке известковым молоком (уравнение 1.4). Образующийся аммиак отгоняют из раствора и направляют на абсорбцию.
Для получения известкового молока необходим оксид кальция, который получают путем обжига карбонатного сырья (мела или известняка) в известково-обжигательных печах при температуре 1100–1200 °С (уравнение 1.1). Образующийся диоксид углерода используют в отделении карбонизации, а СаО используют для получения известкового раствора (уравнение 1.2).
Поступающий сырой рассол (водный раствор хлорида натрия) подвергают предварительной очистке от примесей солей кальция и магния с помощью Na2 CO3 и Са(ОН)2 . В процессе очистки образуются плохо растворимые Mg(OH); и СаСО3 , выпадающие в осадок:
MgCl2 + Ca(OH)2 → Mg(OH)2↓ + CaCl2 (1.6)
CaCl2 + Na2 CO3 → CaCO3↓ + 2NaCl (1.7)
Осадки Mg(OH)2 и СаСО3 удаляют, а очищенный рассол направляют дальше в производство.
2. РЕСУРСО-СЫРЬЕВАЯ БАЗА
Основным сырьем для получения кальцинированной соды на Украине является хлорид натрия, карбонатсодержащее сырьё и аммиак.
В технологии карбоната натрия используют не твердый хлорид натрия, а его водные растворы, содержащие 305–310 г/л соли. Различают естественные и искусственные рассолы.