Курсовая работа: Биогенез мембран
Особый интерес представляет процесс сборки мембранных белков, который целесообразно рассмотреть в связи с их сортировкой. На рис. 2 схематически показаны три общих механизма проникновения пептидного предшественника в мембрану. Механизмы А и Б являются вариантами схемы линейного вытеснения, согласно которой сигнальная последовательность направляет полипептид к переносящему устройству, которое включает в себя заполненный водой канал. Сигнальная последовательность может проходить прямо сквозь канал (механизм А) или оставаться связанной с мембраной, образуя, как показано на рис.2, петлю (механизм Б). В отсутствие какого-либо сигнала остановки процесса переноса полипептид будет транспортироваться через мембрану целиком. Однако, если внутри полипептида имеется второй сигнальный пептид, называемый стоп-сигналом переноса, то процесс останавливается и стоп-сигнал переноса становится трансмембранным сегментом зрелого мембранного белка. Фиксируя белок в мембране, стоп-сигнал переноса действует как сигнал сортировки. Если в белке имеются и другие сигналы начала и конца переноса, то будут образовываться следующие трансмембранные сегменты.Схема В на рис.2 иллюстрирует возможную роль самопроизвольного включения в мембрану гидрофобных элементов полипептидного предшественника. Этот механизм может реализовываться только тогда, когда включение в мембрану происходит после трансляции полипептида. Примером, подтверждающим существование этого механизма, является пробелок оболочки фага М13. Модель самопроизвольного включения может использоваться для объяснения механизма встраивания поперек мембраны амфифильных а-спиралей или β-структур. Этот процесс может также, конечно, быть белокзависимым.
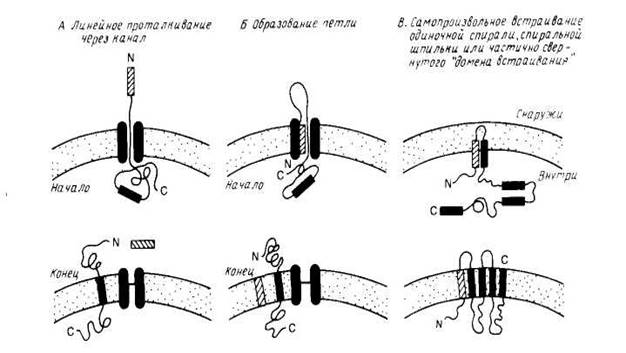
Рис2. Модели встраивания белка
Экспериментальные данные, которые однозначно свидетельствовали бы о существовании каналов, участвующих в сборке мембранных белков или в переносе белков через мембрану, отсутствуют. Известно, впрочем, что как на поверхности митохондрий, так и в эндоплазматическом ретикулуме имеются мембранные рецепторы, которые специфически узнают переносимые белки, и, возможно, именно они являются частью сложного аппарата, куда входит и канал, по которому перемещается белок.
Для того, чтобы перенос белков происходил со скоростью, близкой к скорости синтеза полипептида (1—10 остатков в 1 с), энергетический барьер не должен превышать примерно 18 ккал/моль. По полученным данным , две соседние спирали могут спонтанно встраиваться в бислой с образованием спиральной шпильки, и соответствующий выигрыш свободной энергии ~ 60 ккал/моль может стать движущей силой для частичного втягивания полярных и даже заряженных групп в липидный бислой. Однако, для переноса ионизированных и полярных групп из водного окружения в липидный бислой необходимо большее количество свободной энергии, н вряд ли модель спонтанного встраивания будет применима всегда, поскольку при сборке многих мембранных белков необходимо транспортировать через мембрану длинные, часто сильно заряженные полнпептидные цепи.
Тем не менее было показано, что некоторые небольшие мембранные белки включаются в лнпидные бислон спонтанно. К ним относятся цитохром bs с единственным гидрофобным якорем на С-конце и пробелок оболочки бактериофага М13, предположительно содержащий две трансмембранные спирали, которые, возможно, и встраиваются в бислой с образованием спиральной шпильки или петли. Пробелок оболочки содержит сигнальную последовательность из 23 остатков, обычно отщепляемую при сборке в цитоплазматической мембране Е. coli . Зрелый белок (50 аминокислотных остатков) имеет кислый N-конец, обращенный в периплазматическое пространство, трансмембранный сегмент и основный С-конец, обращенный в цитоплазму. Он спонтанно встраивается в фосфолипидные липосомы, причем скорость его сборки invivo сильно замедляется, если в трансмембранном участке или на С-конце зрелого белка имеются мутации, что согласуется с моделью, в рамках которой два гидрофобных сегмента могут спонтанно встраиваться в липидный бислой в виде шпильки или петли. На рис. 3 представлена схема встраивания этого белка в мембрану. Интересно, что сборка пробелка оболочки вируса М13 может осуществляться и с помощью микросом млекопитающих, причем этот процесс требует АТР, возможно, для поддержания необходимой для транспорта конформации. Следует отметить, что этот белок не типичен для белков, сборка которых осуществляется на плазматической мембране Е. coli , поскольку он имеет отщепляемую сигнальную последовательность, и его сборка происходит независимо от функций генов secA , secY ( prlA ), необходимых для переноса белков внутрь плазматической мембраны или через нее.
Результаты исследования пробелка оболочки бактериофага М13 убедительно проиллюстрировали справедливость механизма самопроизвольного встраивания белков в мембрану без участия белков-посредников. Предполагается, что водорастворимый предшественник приобретает конформацию, обеспечивающую встраивание его в мембрану, при взаимодействии с бислоем. Эта обобщенная модель была предложена как часть «мембранной триггерной гипотезы». Необходимым условием нормального транспорта белка через мембрану является неполное его сворачивание в 3 и 4 структуры.
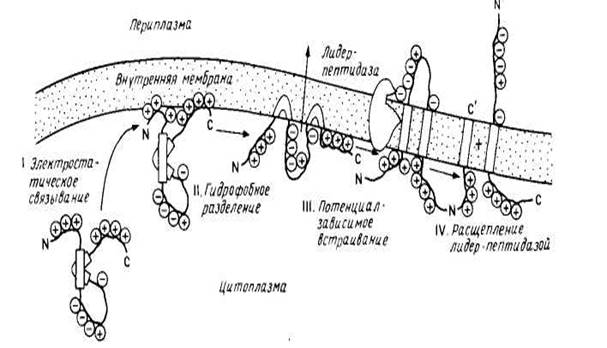
рис.3 модель самопроизвольного встраивания
2.1 Транспорт белков
Необходимо также рассмотреть механизмы с помощью которых белки доставляются к нужному месту. Есть несколько способов основным является экзоцитозный путь.
Экзоцитозным в эукариотических клетках называется путь, с помощью которого осуществляется транспорт белков, секретируемых клеткой или включаемых в наружную мембрану. Секретируемые белки синтезируются на связанных с мембранами рибосомах на цитоплазматической поверхности шероховатого эндоплазматического ретикулума и выводятся из клетки с помощью того же механизма, который используется для включения мембранных белков в эндоплазматический ретикулум.
Если водорастворимый белок не имеет вторичных сигналов сортировки, то он транспортируется к клеточной поверхности и секретируется с помощью «конститутивного» пути. Белки, транспортируемые этим путем, перемещаются из эндоплазматического ретикулума последовательно через различные компартменты комплекса Гольджи и в конце концов попадают на поверхность клетки. Они могут становиться компонентами цитоплазматической мембраны или, при наличии вторичных сигналов сортировки, оставаться в эндоплазматическом ретикулуме (рибофорин, цито-хром Р450) или в комплексе Гольджи (различные гликозилтрансферазы).
В комплексе Гольджи в ходе дальнейшей сортировки отделяются белки, секретируемые конститутивным путем (укороченный путь), от тех, которые направляются в лизосомы или концентрируются в секреторных гранулах, с помощью которых они затем секретируются при соответствующей стимуляции клетки (т. е. регулируемый секреторный путь). Кроме того, обнаружено, что в наружной мембране ядерной оболочки также могут синтезироваться мембранные гликопротеины, которые затем транспортируются с помощью экзоцитоза.Белки при транспортировке по экзоцитозному пути подвергаются посттрансляционным модификациям, в частности гликозилированию. Хорошо изучена компартментация процессинга N-связанного олигосахарида, что очень помогло определению различных компонентов комплекса Гольджи {цис-, медиальных и /пренс-цистерн).
Олигосахаридный предшественник с высоким содержанием маннозы присоединяется по местам гликозилирования в полипептиде (по остаткам аспарагина), когда белок находится внутри эндоплазматического ретикулума, а затем с помощью нескольких расположенных в различных компартментах ферментов осуществляется процесс созревания. Это позволяет следить за превращением белков, определяя состояние их гликозирования.
Исследования выявили несколько замечательных особенностей системы экзоцитозного транспорта.
1. Транспорт между различными компартментами органеллы осуществляется с помощью везикул, которые отпочковываются от «донорной» мембраны и потом сливаются с «акцепторной». Показано, что везикулы, участвующие в транспорте между компартментами комплекса Гольджи, являются «окаймленными», но соответствующий белок отличается от клатрина, окаймляющего эндоцитозные везикулы. Имеются веские данные в пользу того, что клатрин не является существенным компонентом экзоцитозного пути, хотя он, по-видимому, необходим для нормального роста некоторых штаммов дрожжей.
2. Для внутриклеточного транспорта необходим АТР, а также белковые компоненты цитозоля. Показано, что для транспорта между цистернами Гольджи, осуществляющегося при участии везикул, необходимо жирнокислотное производное ацил-СоА . Какую именно функцию выполняют указанные соединения в отпочковывании и слиянии везикул, неизвестно.
3. Роль олигосахарида как сигнала сортировки новосинтезированных гликопротеинов, по-видимому, непостоянна.
2.2 Сигнальные последовательности белков
У большинства белков, встроенных в мембрану эндоплазматического ретикулума или пересекающих ее, на N-конце имеется «короткоживущий» сигнальный пептид (от 15 до 30 аминокислотных остатков). Эта сигнальная последовательность непосредственно взаимодействует по крайней мере с двумя рецепторами, один из которых растворим (сигналраспознающая частица), а другой находится в мембране. Можно было бы ожидать, что аминокислотная последовательность этого сигнального пептида будет очень консервативной и примерно одинаковой у всех переносимых белков, но ожидания эти не оправдались. Эти сигнальные участки не отличаются постоянством ни в отношении длины, ни в отношении аминокислотной последовательности, а многочисленные опыты по мутагенезу показали, что они могут претерпевать значительные структурные изменения. Данные о том, что сигнальные пептиды содержат всю информацию, необходимую для транспорта белков через мембраны эндоплазматического ретикулума или внутрь их, были получены в опытах с химерными полипептидами. Присоединение N-концевой сигнальной последовательности к обычным цитоплазматическим белкам, например к глобину, приводило к тому, что они транспортировались в полость эндоплазматического ретикулума.
С точки зрения «сравнительной анатомии» N-концевых сигнальных последовательностей можно выделить три разных в структурном отношении участка: 1) положительно заряженный N-концевой участок (п-участок); 2) центральное гидрофобное ядро из 7—15 остатков (h-участок); З) С-концевой участок (с-участок), который является полярным и содержит сайт, узнаваемый сигнальной пепти-дазой, которая находится на стороне эндоплазматического ретикулума, обращенной в полость. Показано, что многочисленные случайные последовательности способны выполнять функцию нормального сигнального пептида у инвертазы дрожжей и детерминировать ее секрецию. Анализ этих случайных последовательностей показал, что решающим фактором является их гидрофобность. Приведены данные о гидрофобности и длине гидрофобных участков известных сигнальных пептидов эукариот и большинства гидрофобных участков, обнаруженных в цитозольных белках эукариот (многие из которых расположены на N-конце), а также известных трансмембранных якорных участков мембранных белков. Из этих данных видно, что h-область обладает свойствами, промежуточными между свойствами соответствующих участков цитозольных белков, с одной стороны, и типичных трансмембранных сегментов — с другой.
Очевидно, структурная специфичность для процесса узнавания не играет существенной роли. Однако необходимо помнить, что изменение свободной энергии менее чем на 5 ккал/моль (примерно такова энергия одной водородной связи) соответствует изменению сродства в 1000 раз. Такое различие в сродстве вполне может быть обусловлено тонкими различиями между функциональными и нефункциональными сигнальными последовательностями. Моделью рецептора сигнального пептида может служить растворимый фрагмент антигена гистосовместимости класса I, а именно HLA-A2, трехмерная структура которого известна. Этот белок связывается с пептидами — компонентами чужеродных антигенов, что является частью иммунного ответа. Область связывания пептида представляет собой большой желобок, открытый с одного конца и способный вмещать пептид из 20 аминокислотных остатков, если тот имеет форму а-спирали. О пептидах, которые могут связываться с HLA-A2, известно немного; показано, в частности, что близкородственный антиген гистосовместимости класса II проявляет высокое сродство к самым разным аминокислотным последовательностям. По-видимому, наиболее важными ббщими характеристиками пептидов, которые могут связываться с высоким сродством, являются вторичная структура и амфифильность. Стабилизации комплекса могут способствовать многочисленные взаимодействия в области связывания.
Известно, что относительно небольшие различия между сигнальными последовательностями порождают огромные различия в поведении белка. Например, если сигнальная последовательность не распознается сигнальной пептидазой, то белок чаще остается связанным с мембраной, чем секретируется, хотя есть и исключения из этого правила. Обычно сигнальные последовательности, которые служат также N-концевыми якорями,имеют более протяженный гидрофобный h-участок длиной около 20 аминокислотных остатков; этот участок необходим для остановки переноса и/или образования стабильного якоря в мембранном бислое . Примером такой сигнальной/якорной последовательности служит трансферриновый рецептор. Заметим, что в этом случае сигнальная последовательность расположена не иа N-конце, а на расстоянии более чем 50 аминокислотных остатков от него.
Известны также случаи, когда сигнальная последовательность закрепляет зрелый белок в противоположной ориентации, т. е. N-конец оказывается обращенным наружу. В качестве примера можно привести цитохром Р450 микросом крысы.
Каким-то образом эти сигналь-ные/якориые последовательности «проталкивают» свой N-коиец через мембрану и останавливают трансляцию, так что основная часть белка остается в цитоплазме. Отмечалось, что в некоторых из этих случаев сигнальные последовательности «старт/стоп» несут по крайней мере одни отрицательный заряд в п-области. Однако для встраивания указанных мембранных белков, как и белков обычного типа, используется одинаковый аппарат переноса — СРЧ. Возможно, наличие отрицательного заряда облегчает самопроизвольный или опосредованный белком перенос N-концевых остатков через мембрану.
Как мы уже отмечали, сигнальные последовательности не обязательно находятся на N-конце белковой молекулы и могут направлять перенос обоих фланкирующих домеиов, по крайней мере в случае искусственных гибридных белков. Уникальным примером такого рода является овальбумин, секреция которого детерминируется неотщепляемой внутренней сигнальной последовательностью. У многих мембранных белков эндоплазматического ретикулума неотщепляемые сигнальные последовательности тоже расположены в средней части полипептидиой цепи и играют роль трансмембраниых якорей. В качестве примера можно привести асиалогликопротеиновый рецептор. Внутренняя сигнальная последовательность этого белка использует тот же аппарат переноса, что и N-концевая последовательность; и действительно, в искусственных гибридах эта внутренняя сигнальная последовательность функционирует как обычная N-концевая последовательность. Примерами белков с внутренней неотщепляемой сигнальной последовательностью, которые имеют многочисленные трансмембраниые сегменты и N-конец которых находится на внутренней стороне мембраны, служат переносчик глюкозы и анионный переносчик белок полосы 3. Напротив, у опсина, тоже содержащего внутренний неотщепляемый сигнальный пептид, N-конец находится с наружной стороны мембраны. Этот внутренний сигнал (предположительно первый трансмембранный сегмент) протягивает гидрофильный аминокислотный домен (36 аминокислотных остатков) через мембрану, и, таким образом, его ориентация противоположна той, которая наблюдается в более общем случае при переносе полипептида, начиная с С-конца. Причина такого поведения опсина неизвестна; возможно, важную роль играет природа N-концевого пептида.
Итак, от небольших изменений в сигнальных последовательностях зависит, будет ли «белок-пассажир» секретироваться в полостьэндоплазматического ретикулума или он останется прикрепленным к мембране, и какой будет ориентация N-конца мембранного белка. Было показано, что существуют все возможные топологические варианты. Важным моментом является то, что во всех случаях сборка осуществляется при помощи одного и того же аппарата.
2.3 Стоп-сигналы переноса
Как отмечалось в предыдущем разделе, для неотщепляемых сигнальных последовательностей, которые играют роль N-концевых якорей в образовавшемся мембранном белке, характерно наличие относительно длинных гидрофобных участков. Отсюда следует, что перенос может останавливаться просто при наличии протяженного гидрофобного участка, который способен образовать трансмембранную а-спираль. В пользу такого предположения свидетельствуют некоторые экспериментальные данные. Например, с помощью рекомбинантной ДНК в среднюю часть белка £. coli , в норме секретирующегося через плазматическую мембрану, встраивали гидрофобные сегменты. Если их длина была не менее 16 аминокислотных остатков, то транспорт белка блокировался и он оставался присоединенным к плазматической мембране. Можно возразить, что в данном случае речь идет о бактериальной системе, но, как мы увидим ниже (см. раздел, посвященный сигнальным последовательностям бактерий), механизмы переноса в про- и эукариотических системах, по-видимому, сходны. Далее были сконструированы варианты G-белка вируса везикулярного стоматита с измененными мембранными доменами. Длина гидрофобного сегмента могла составлять не 20, а 8 остатков, при этом полипептид оставался трансмембранным, хотя транспорт в плазматическую мембрану блокировался. Таким образом, природа стоп-сигнала переноса точно не известна. Необходимо выяснить два вопроса: 1) участвуют ли в остановке процесса специфические белки аппарата переноса; 2) определяется ли остановка переноса гидрофобиостью стоп-сигнала или какими-то более тонкими факторами? Было показано, что участки стоп-сигнальиой последовательности, ответственные за блокирование переноса через эндоплазматический ретикулум, могут никак не влиять на транспорт через мембрану хлоропласта. Это означает, что упомянутые два процесса могут существенно различаться.
Определение старт- и стоп-сигналов подразумевает линейную схему переноса, начинающегося с N-конца; об этом свидетельствует поведение простых систем. Однако оказалось, что последовательности, которые блокируют перенос в одном случае, могут инициировать его в другом.
Следовательно важна не только последовательность но и ее окружение в полипептиде.
2.4 Сигнальные пептидазы
Для удаления временных N-концевых сигнальных пептидов необходимы специфические белки. Наиболее полно охарактеризованы сигнальные протеазы из Е. coli . Большинство экспортируемых белков Е. coli содержат сигнальный пептид, который отщепляется на периплазматической поверхности внутренней мембраны с помощью лидер-пептидазы. Для переноса белков через внутреннюю мембрану эта пептидаза не нужна, но она необходима для высвобождения экспортируемого белка из цитоплазматической мембраны. Invitro очищенный фермент мог функционировать, будучи включенным в липосомы. Специфичность расщепления весьма высока, но не определяется исключительно аминокислотной последовательностью вблизи сайта расщепления.
Сигнальная пептидаза, функционирующая в эндоплазматическом ретикулуме, имеет ту же специфичность, что и соответствующий фермент Е. coli , что неудивительно, если учесть сходство сигнальных последовательностей. Была очищена сигнальная пептидаза из микросом эукариот. Показано, что она ассоциирована с другими полипептидами, возможно имеющими отношение к механизму переноса.
У Е. coli имеется вторая сигнальная пептидаза, участвующая в процессинге пролипопротеинов. Эти полипептидные компоненты оболочки Е. coli замечательны тем, что при созревании их N-конец модифицируется с помощью глицерида. Пролипопротеи-новая сигнальная пептидаза также находится в цитоплазматической мембране. После отщепления сигнальный пептид остается в цитоплазматической мембране и разрушается с помощью мембра-носвязанного фермента протеазы IV.
В митохондриях и хлоропластах должно присутствовать несколько сигнальных пептидаз, поскольку процессинг происходит более чем в одном компартменте . Растворимую пептидазу из митохондриального матрикса удалось частично очистить, но охарактеризована она не полностью.
2.5.Белки необходимые для узнавания сигнальных последовательностей