Курсовая работа: Биотехнология глутамата натрия
Четвертую реакцию гликолиза катализирует фермент альдолаза. Под влиянием этого фермента происходит расщепление на две фосфотриозы:
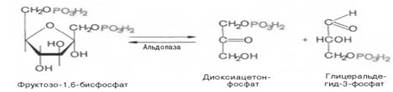
Эта реакция обратима. В зависимости от температуры равновесие устанавливается на различном уровне. При повышении температуры реакция сдвигается в сторону большего образования триозофосфатов.
Пятая реакция – это реакция изомеризации триозофосфатов. Катализируется ферментом триозофосфатизомеразой:

В результате шестой реакции глицеральдегид-3-фофат в присутствии фермента дегидрогеназы, кофермента НАД и неорганического фосфата подвергается своеобразному окислению с образованием 1,3-биофосфоглицериновой кислоты и восстановленной формы НАД (НАДН):


1,3-Биофосфоглицерат представляет собой высокоэнергетическое соединение. Механизм действия дегидрогеназы сводится к следующему: в присутствии неорганического фосфата НАД+ выступает как акцептор водорода, отщепляющегося от глицеральдегид-3-фосфата. В процессе образования НАДН глицеральдегид-3-фосфат связывается с молекулой фермента за счет SН-групп последнего. Образовавшаяся связь богата энергией, но она непрочная и расщепляется под влиянием неорганического фосфата, при этом образуется 1,3-биофосфоглицериновая кислота.
Седьмая реакция катализируется фосфоглицераткиназой, при этом происходит передача богатого энергией фосфатного остатка на АДФ с образованием АТФ и 3-фосфоглицериновой кислоты:

Т.о., благодяря действию двух ферментов (глицеральдегидфосфатдегидрогеназы и фосфоглицераткиназы) энергия, высвобождающаяся при окислении альдегидной группы глицеральдегид-3-фосфата до карбоксильной группы, запасается в форме энергии АТФ. В отличие от окислительного фосфорилирования образование АТФ из высокоэнергетических соединений называется субстратным фосфорилированием.
Восьмая реакция сопровождается внутримолекулярным переносом оставшейся фосфатной группы, и 3-фосфоглицериновая кислота превращается в 2-фосфоглицериновую кислоту. Реакция легкообратима, протекает в присутствии ионов магния:

Девятая реакция катализируется ферментом енолазой, при этом 2-фосфоглицериновая кислота в результате отщепления молекулы воды переходит в фосфоенолпировиноградную кислоту, а фосфатная связь в положении 2 становится высокоэргической. Енолаза активируется катионами Mg2+ и Mn2+ и ингибируется фторидом.

Десятая реакция характеризуется разрывом выскоэргической связи и переносом фосфатного остатка от фосфоенолпирувата на АДФ. Катализируется ферментом пируваткиназой:

Для дествия пируваткиназы необходимы Mg2+ , а также одновалентные катионы щелочных металлов.
В результате одиннадцатой реакции пируват под влиянием пируваткарбоксилазы и при участии СО2 и АТФ карбоксилируется с образованием оксалоацетата:

Двенадцатая реакция катализируется ферментом цитрат-синтетазой, при этом ацетильная группа ацетил-КоА конденсируется с оксалоацетатом, в результате чего образуется лимонная кислота:

Ацетил-КоА Оксалоацетат Цитрат
Тринадцатая реакция – дегидратация лимонной кислоты с образованием цис-аконитовой кислоты, которая, присоединяя молекулу воды, переходит в изолимонную кислоту. Катализирует эти обратимые реакции гидратации-дегидратации фермент аконитатгидратаза. В результате происходит взаимоперемещение Н и ОН в молекуле цитрата:

В результате четырнадцатой реакции происходит образование α-кетоглутарата. Изоцитрат дегидрируется в присутствии НАД-зависимой изоцитратдегидрогеназы. В ходе реакции изоцитрат одновременно декарбоксилируется. НАД-зависимый фермент является аллостерическим ферментом, которому в качестве специфического активатора необходим АДФ. Кроме того, фермент для проявления своей активности нуждается в ионах Mg2+ и Mn2+ . Происходит выделение CO2 .

В ходе пятнадцатой реакции – ферментативного восстановительного аминирования α-кетоглутаровой кислоты НАДФ-зависимой глутаматдегидрогеназой – образуется глутаминовая кислота:
НООС – СН2 – СН2 – СО – СООН + НАД(Ф)Н2 + NН3 →