Курсовая работа: Гальванические элементы
Химические источники тока (аббр. ХИТ) — устройства, в которых энергия протекающих в них химических реакций непосредственно превращается в электрическую энергию.
История создания
Вольтов столб
Первый химический источник тока был изобретён итальянским учёным Алессандро Вольта в 1800 году. Это был элемент Вольта — сосуд с солёной водой с опущенными в него цинковой и медной пластинками, соединенными проволокой. Затем учёный собрал батарею из этих элементов, которая в последствии была названа Вольтовым столбом. Это изобретение в последствии использовали другие учёные в своих исследованиях. Так, например, в 1802 году русский академик В. В. Петров сконструировал Вольтов столб из 2100 элементов для получения электрической дуги. В 1836 году английский химик Джон Дэниель усовершенствовал элемент Вольта, поместив цинковый и медный электроды в раствор серной кислоты. Эта конструкция стала называться «элементом Даниэля». В 1859 году французский физик Гастон Плантэ изобрёл свинцово-кислотный аккумулятор. Этот тип элемента и по сей день используется в автомобильных аккумуляторах. В 1865 году французский химик Ж. Лекланше предложил свой гальванический элемент (элемент Лекланше), состоявший из цинкового стаканчика, заполненного водным раствором хлористого аммония или другой хлористой соли, в который был помещён агломерат из оксида марганца(IV) MnO2 с угольным токоотводом. Модификация этой конструкции используется до сих пор в солевых батарейках для различных бытовых устройств. В 1890 году в Нью-Йорке Конрад Губерт, иммигрант из России, создаёт первый карманный электрический фонарик. А уже в 1896 году компания National Carbon приступает к массовому производству первых в мире сухих элементов Лекланше «Columbia».
II . Принцип действия
Устройство «багдадских батареек» (200 г. до н. э.).
Основу химических источников тока составляют два электрода (катод, содержащий окислитель и анод, содержащий восстановитель), контактирующих с электролитом. Между электродами устанавливается разность потенциалов — электродвижущая сила, соответствующая свободной энергии окислительно-восстановительной реакции. Действие химических источников тока основано на протекании при замкнутой внешней цепи пространственно разделённых процессов: на катоде восстановитель окисляется, образующиеся свободные электроны переходят, создавая разрядный ток, по внешней цепи к аноду, где они участвуют в реакции восстановления окислителя.
В современных химических источниках тока используются:
в качестве восстановителя (на аноде) — свинец Pb, кадмий Cd, цинк Zn и другие металлы;
в качестве окислителя (на катоде) — оксид свинца(IV) PbO2, гидроксид никеля NiOOH, оксид марганца(IV) MnO2 и другие;
в качестве электролита — растворы щелочей, кислот или солей.
III . Классификация, устройство и принцип действия
По возможности или невозможности повторного использования химические источники тока делятся на:
1. Гальванический элемент
Гальванический элемент - химический источник электрического тока, названный в честь Луиджи Гальвани. Принцип действия гальванического элемента основан на взаимодействии двух металлов через электролит, приводящем к возникновению в замкнутой цепи электрического тока. ЭДС гальванического элемента зависит от материала электродов и состава электролита. Это первичные ХИТ, которые из-за необратимости протекающих в них реакций, невозможно перезарядить.
Гальванические элементы являются источниками электрической энергии одноразового действия. Реагенты (окислитель и восстановитель) входят непосредственно в состав гальванического элемента и расходуются в процессе его работы. Гальванический элемент характеризуется ЭДС, напряжением, мощностью, емкостью и энергией, отдаваемой во внешнюю цепь, а также сохраняемостью и экологической безопасностью.
ЭДС определяется природой протекающих в гальваническом элементе процессов. Напряжение гальванического элемента U всегда меньше его ЭДС в силу поляризации электродов и потерь сопротивления:
U = Eэ – I(r1–r2) – ΔE,
где Еэ – ЭДС элемента; I – сила тока в режиме работы элемента; r1 и r2 – сопротивление проводников I и II рода внутри гальванического элемента; ΔЕ – поляризация гальванического элемента, складывающаяся из поляризаций его электродов (анода и катода). Поляризация возрастает с увеличением плотности тока (i), определяемой по формуле i = I/S, где S – площадь поперечного сечения электрода, и ростом сопротивления системы.
В процессе работы гальванического элемента его ЭДС и, соответственно, напряжение постепенно снижаются в связи с уменьшением концентрации реагентов и увеличением концентрации продуктов окислительно-восстановительных процессов на электродах (вспомним уравнение Нернста). Однако чем медленнее снижается напряжение при разряде гальванического элемента, тем больше возможностей его применения на практике. Емкостью элемента называют общее количество электричества Q, которое гальванический элемент способен отдать в процессе работы (при разрядке). Емкость определяется массой запасенных в гальваническом элементе реагентов и степенью их превращения. При увеличении тока разряда и снижении температуры работы элемента, особенно ниже 00С, степень превращения реагентов и емкость элемента снижаются.
Энергия гальванического элемента равна произведению его емкости на напряжение: ΔН = Q.U. Наибольшей энергией обладают элементы с большим значением ЭДС, малой массой и высокой степенью превращения реагентов.
Сохраняемостью называют продолжительность срока хранения элемента, в течение которого его характеристики остаются в заданных параметрах. С ростом температуры хранения и эксплуатации элемента, его сохраняемость уменьшается.
Состав гальванического элемента : восстановителями (анодами) в портативных гальванических элементах, как правило, служат цинк Zn, литий Li, магний Mg; окислителями (катодами) – оксиды марганца MnO2, меди CuO, серебра Ag2O, серы SO2, а также соли CuCl2, PbCl2, FeS и кислород О2.
Самым массовым в мире остается производство марганец–цинковых элементов Mn–Zn, широко применяемых для питания радиоаппаратуры, аппаратов связи, магнитофонов, карманных фонариков и т.п. Конструкция такого гальванического элемента представлена на рисунке
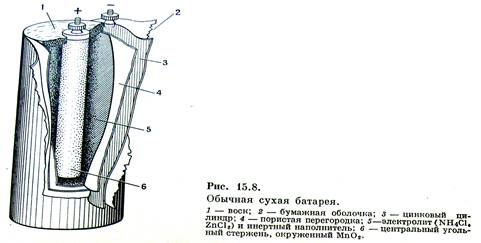
Токообразующими реакциями в этом элементе являются :
- на аноде (–): Zn – 2ē → Zn2+ (на практике происходит постепенное растворение цинковой оболочки корпуса элемента);
- на катоде (+): 2MnO2 + 2NH4+ + 2ē → Mn2O3 + 2NH3 + H2O.
В электролитическом пространстве также идут процессы: