Курсовая работа: Гальванические элементы
- у катода Mn2O3 + H2O → [Mn2O2(OH)2] или 2[MnOOH].
В молекулярном виде химическую сторону работы гальванического элемента можно представить суммарной реакцией:
Zn + 2MnO2 + 2NH4Cl → [Zn(NH3)2]Cl2 + 2[MnOOH].
Схема гальванического элемента:
(–) Zn|Zn(NH3)2]2+||[MnOOH]|MnO2 (С) (+).
ЭДС такой системы составляет Е= 1,25 ÷ 1,50В.
Гальванические элементы с подобным составом реагентов в щелочном электролите (КОН) имеют лучшие выходные характеристики, но они неприменимы в портативных устройствах в силу экологической опасности. Еще более выгодными характеристиками обладают серебряно-цинковые элементы Ag-Zn, но они чрезвычайно дороги, а значит, экономически неэффективны. В настоящее время известно более 40 различных типов портативных гальванических элементов, называемых в быту «сухими батарейками».
2. Электрические аккумуляторы
Электрические аккумуляторы (вторичные ХИТ)— перезаряжаемые гальванические элементы, которые с помощью внешнего источника тока (зарядного устройства) можно перезарядить.
Аккумуляторы – это устройства, в которых под воздействием внешнего источника тока в системе накапливается (аккумулируется) химическая энергия (процесс зарядки аккумулятора), а затем при работе устройства (разрядка) химическая энергия снова превращается в электрическую. Таким образом, при зарядке аккумулятор работает как электролизер, а при разрядке – как гальванический элемент.
В упрощенном виде аккумулятор представляет собой два электрода (анод и катод) и ионный проводник между ними – электролит. На аноде как при разряде, так и при заряде протекают ре6акции окисления, а на катоде – реакции восстановления.
До последнего времени по-прежнему наиболее распространенными в России, да и в Приднестровье, остаются кислотные свинцовые и щелочные никель-кадмиевые и никель-железные аккумуляторы.
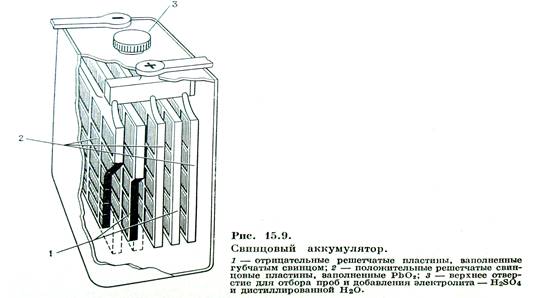
Электроды в нем представляют собой свинцовые решетки, из которых одна заполняется в порах порошком оксида свинца IV – PbO2. Электроды соединены с электролитом через пористый сепаратор. Всеь аккумулятор помещается в бак из эбонита или полипропилена.
При работе такого устройства в нем происходят следующие электродные процессы:
А). Разрядка или работа аккумулятора как источника электрической энергии.
На аноде : (–) Pb – 2ē → Pb2+;
на катоде : (+) PbO2 + 4H+ + 2ē → Pb2+ + 2H2O.
Образующиеся на электродах катионы свинца взаимодействуют с анионами электролита с выделением белого осадка сульфата свинца
Pb2+ + SO42– = ↓PbSO4.
Суммарная токообразующая реакция процесса разрядки аккумулятора:
Pb + PbO2 + 2H2SO4 = 2PbSO4↓ + 2H2O,
а схема работающего аккумулятора как гальванического элемента имеет вид (–) Pb|PbSO4||PbO2 (+).
Напряжение на клеммах работающего аккумулятора достигает величины 2,0÷2,5В. В процессе эксплуатации устройства электролит расходуется, а в системе накапливается осадок. Когда концентрация активных ионов водорода [Н+] становится критической для реакции на катоде, аккумулятор прекращает свою работу.
Б). Зарядка или восстановление химического потенциала аккумулятора для последующего его преобразования в электрическую энергию. Для этого аккумулятор подсоединяют к внешнему источнику тока таким образом, что к клемме «анод» подается отрицательный полюс, а к клемме «катод» - положительный. В этом случае на электродах под действием внешнего напряжения возникают обратные процессы, восстанавливающие их до первоначального состояния.
Металлический свинец восстанавливает поверхность электрода (–): PbSO4 + 2ē → Pb + SO42;
Образующийся оксид свинца IV заполняет поры свинцовой решетки (+): PbSO4 + 2H2O – 2ē → ↓PbO2 + 4H+ + SO42.
Суммарная восстановительная реакция: 2PbSO4 + 2H2O = Pb + PbO2 +2H2SO4.
Определить момент окончания процесса зарядки аккумулятора можно по появлению пузырьков газа над его клеммами («кипение»). Это связано с возникновением побочных процессов восстановления катионов водорода и окисления воды с ростом напряжения при восстановлении электролита: