Курсовая работа: Харчова добавка Тіосульфат натрію Е 539
На зовнішній вигляд Na2 S2 O3 – це безбарвні кристали, що не злежуються, гранули або білий кристалічний порошок. Можливий жовтуватий або слабо-рожевий відтінок. Кристалічна форма – моноклінна (а = 0,8513 нм, b = 0,8158 нм, с = 0,6425 нм, b = 97,08 °, z = 4). Тіосульфат натрію на повітрі стійкий до 800 С, при нагріванні у вакуумі при 3000 С розкладається на сульфіт натрію та сірку. Добре розчинний у воді ((г в 100 г): 50,1 (0°С), 70,2 (20 °С), 231,8 (80 °С)), проте нестійкий. При температурі 11 - 480 С з води кристалізується у вигляді пентагідрату Na2 S2 O3 ·5Н2 О. Окрім пентагідрату тіосульфату натрію, відомий декагідрат натрію, який має формулу Na2 S2 O3 ·10Н2 О. Кристалогідрати іншої молекулярної формули не виявлені.
Молярна маса речовини : М(Na2 S2 O3 ) = 158,11 г/моль.
Молярна маса пентагідрату: М(Na2 S2 O3 ·5Н2 О) = 248,17 г/моль.
Густина речовини 1,667 г/см3 .
ΔH0 обр (a) -1136 кДж/моль
Розчинність в 100г холодної води складає 66,7г, а в гарячій воді 266г. Тіосульфат натрію розчинний також в аміаку NH3 , у водних розчинах SO2 , слабо розчинний в спиртах (етанолі).
При 48,50 С гіпосульфіт плавиться в своїй кристалізаційній воді, зневоднюється близько 1000 С.
При введенні в організм тіосульфат натрію надає протизапальний, протитоксичний та десенсибілізуючий ефекти. Знешкоджує препарати йоду та виказують протипаразитну дію.
1.3 Методи одержання тіосульфату натрію
а) окисненням полісульфідів Na;
б) кип’ятіння надлишку сірки з Na2 SO3 :
S + Na2 SO3 → Na2 S2 O3 ;
в) взаємодією H2 S та SO2 з NaOH (побічний продукт при виробництві NaHSO3 , сірчаних барвників, при очищенні промислових газів від S):
4SO2 + 2H2 S + 6NaOH → 3Na2 S2 O3 + 5H2 O;
г) кип’ятіння надлишку сірки з гідроксидом натрію:
3S + 6NaOH → 2Na2 S + Na2 SO3 + 3H2 O,
потім за приведеною вище реакцією сульфіт натрію приєднує сірку, утворюючи тіосульфат натрію.
Одночасно в ході цієї реакції утворюються полісульфиди натрію (вони надають розчину жовтий колір). Для їх руйнування в розчин пропускають SO2 .
д) чистий безводний тіосульфат натрію можна отримати реакцією сірки з нітритом натрію у формаміді. Ця реакція кількісно протікає (при 80°C за 30 хвилин) за рівнянням:
2NaNO2 + 2S → Na2 S2 O3 + N2 O↑
е) розчинення сульфіду натрію у воді у присутності кисню повітря :
2Na2 S + 2O2 + H2 O = Na2 S2 O3 + 2NaOH
1.4 Хімічні властивості тіосульфату натрію
а) загальні хімічні властивості тіосульфату натрію
Тіосульфат натрію можна віднести до досить нестійких речовин. При нагріванні до 2200 С розпадається відповідно до схеми:
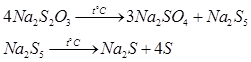
В реакції термічного розкладу тіосульфату натрію отримують полісульфід натрію, котрий також далі розкладається на сульфід натрію та елементарну сірку.
Розчини тіосульфату натрію нестабільні через взаємодію з вуглекислим газом, що міститься в повітрі та розчинений у воді:
S2 O3 2- + CO2 + H2 O →HSO3 - +S↓ + HCO3 -