Курсовая работа: Харчова добавка Тіосульфат натрію Е 539
S2 O3 2- + O2 →2SO4 2- +S↓
Тому готувати розчин тіосульфату натрію з наважки недоцільно, зазвичай готують розчин приблизної концентрації та встановлюють точну концентрацію титруванням розчином біхромату калію або розчином йоду.
При йодометричному титруванні застосовують метод зворотного титрування, так як додають надлишок розчину йодиду калію точної концентрації, а потім титрують йод, що утворився, розчином тіосульфату натрію, наприклад, при визначенні Fe3+ :
2Fe3+ + 2I- →I2 + 2Fe2+
![]()
Оскільки йод навіть в слабкокислих розчинах містить гіпойодид-іони, що утворюються в результаті його гідролізу, які є більш сильними окисниками, ніж йод, і окислюють тіосульфати до сульфатів, помітно може проходити побічна реакція:
S2 O3 2- + 4I2 +10OH- →2SO4 2- + 8I- + 5H2 O
При збільшенні концентрації гідроксил-іонів збільшується кількість тіосульфату, який окислюється до сульфату. В сильно лужному середовищі ця реакція проходить кількісно, йодат-іони в ході реакції не утворюються.
Хоча реакція між йодом та тіосульфатом проходить швидко і якась кількість тетратіонату утворюється одразу після змішування, було доведено утворення безбарвної проміжної сполуки S2 O3 І- в результаті швидкої зворотної реакції
S2 O3 2- + I3 - ↔ S2 O3 І- + 2I-
Проміжна сполука вза’ємодіє з йодидом:
S2 O3 І- + I- → S4 O6 2- + 2I3 - ,
Чим і пояснюється повторна поява йоду поблизу кінцевої точки при титруванні дуже розбавлених розчинів йоду.
Виділити тіосірчану кислоту Н2 S2 O3 реакцією тіосульфату натрію з сильною кислотою неможливо, так як вона нестійка і одразу розкладається:
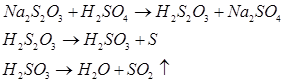
В таку ж реакцію буде вступати соляна та азотна кислоти. Розкладання супроводжується виділенням SO2 , який має неприємний запах и подразнює слизові оболонки дихальних шляхів, що потребує обережності при роботі з ним.
б) Окисно-відновні властивості тіосульфату натрію
У зв’язку з наявністю атомів сірки зі ступенем окиснення 0 іон тіосульфату S2 O3 2- має відновні властивості. Наприклад, слабкими окисниками (І2 , Fe3+ ) тіосульфат окиснюється до іона тетратіоната:
![]()
Наведена реакція дуже важлива, так як є основою йодометрії.
Більш сильні окисники окислюють його до іона сульфату:
![]()
Слід також відмітити, що в лужному середовищі окиснення тіосульфату натрію йодом теж може проходити до сульфату.
Сильними відновниками іон S2 O3 2- відновлюється до похідних S2- :
![]()
Як видно з наведених реакцій, в залежності від умов, тіосульфат натрію може проявляти як окисні, так і відновні властивості.
в) комплексоутворюючі властивості тіосульфатів
Тіосульфат-іон – сильний комплексоутворювач, що використовується в фотографії для видалення з фотоплівки невідновленого броміду срібла:
![]()