Курсовая работа: Химический состав винограда
На выпадение в осадок труднорастворимых калиевых и кальциевых солей влияет ряд факторов: температура, концентрация ионов водорода, наличие в вине некоторых аминокислот и другие.
Соли винной кислоты обладают свойством образовывать растворимые комплексные соединения с металлами. В практике аналитической химии интерес представляет комплекс следующего строения, который образуется при взаимодействии медного купороса и едкого кали в присутствии сеньетовой соли. Не меньшее значение имеет комплексная соль винной кислоты с железом. Она участвует в процессах созревания и старения вина, являясь катализатором этих процессов. Растворимость солей винной кислоты в вине отличается от растворимости их в водно-спиртовых растворах. Так, растворимость тартрата кальция в вине в 2-7 раз выше, чем в водно-спиртовых растворах. Это обусловлено действием разных стабилизирующих веществ, например, аспарагиновой кислоты, глицина, лейцина, фенилаланина.
Среди других стабилизирующих агентов, влияющих на растворимость виннокислых солей, значительное внимание привлекают вещества, находящиеся в вине в коллоидном состоянии - защитные коллоиды. К ним можно отнести продукты типа меланоидинов, образующиеся при тепловой обработке вин, и растительные камеди. Защитным свойством обладают гексаметафосфаты, мезовинная кислота, а также метавинная кислота и ряд продуктов, образующихся во время нагревания при высокой температуре некоторых органических кислот - лимонной и щавелевой. Это свойство некоторых веществ задерживать выделение в осадок виннокислых солей используется на практике.
Таким веществом, получившим широкое применение в виноделии, явилась метавинная кислота. Она получается при нагревании D- винной кислоты при температуре 170°C в течение четырёх часов. В количестве 0,10 - 0,15 г/дм3 она предотвращает выпадение винного камня и образование в связи с этим помутнений.
Метавинная кислота представляет собой смесь нескольких полимеров, из которых главным является полимер следующего строения:
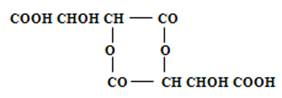
Метавинная кислота - твёрдое вещество, весьма гигроскопичное и легко растворяющееся в воде. В водных растворах она постепенно присоединяет воду и снова превращается в винную кислоту. Кислотность метавинной кислоты приблизительно наполовину меньше кислотности винной. Метавинная кислота не изменяет вкуса, а также цвета вина. В вино её можно вводить в виде солей K, Na или Li. Устойчивость метавинной кислоты в вине зависит от температуры хранения. При температуре 20-23°C она гидролизуется в течение трёх месяцев, после чего происходит выпадание винного камня. При температуре 4-5°C гидролиз наступает через десять месяцев, поэтому в течение этого времени вино устойчиво.
Винная кислота и её соли имеют большое значение не только в виноделии, но и в других отраслях народного хозяйства. Так, её широко используют при изготовлении различных кондитерских изделий, в производстве безалкогольных напитков, в медицине. Сырьём для получения винной кислоты служат виноградная выжимка и винный камень, в больших количествах оседающий на стенках емкостей, в которых хранится вино.
Кроме винной кислоты в виноградной ягоде, особенно в начальный период созревания, идёт образование яблочной кислоты (от 1 до 25 г/л). Она расходуется интенсивно на дыхательные процессы. Установлено, что в районах с жарким климатом, где дыхательные процессы протекают более энергично, к концу созревания расходуется больше яблочной кислоты, чем винной, и вино, полученное из такого винограда, менее кислое. В северных районах, наоборот, в винах преобладает яблочная кислота. Содержание её также зависит от сорта винограда. Яблочная кислота гигроскопична, хорошо растворима в воде, плоха – в спирте и ещё хуже в диэтиловом эфире.
Яблочная кислота (acidummalicum) C4 H6 O5 является двухосновной кислотой, но содержит только одну оксигруппу:
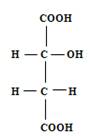
Яблочная кислота (оксиянтарная) может существовать в трёх изомерных формах: двух оптически деятельных (право- и левовращающей) и в рацемической - оптически недеятельной. В винограде и других растениях она находится только в одной L-форме.
L-яблочная кислота представляет собой белое кристаллическое6 вещество, хорошо растворимое в воде; температура плавления 100°C. Средние и кислые соли яблочной кислоты называются малатами (от латинского названия acidummalicum – кислота яблочная). Они хорошо растворимы в воде и поэтому не вызывают помутнений кристаллического характера, как некоторые из солей винной кислоты.
В винограде некоторых сортов кроме винной и яблочной кислот найдена лимонная кислота, содержание которой колеблется от 0,019 до 0,7 г/л. Лимонная кислота трёхосновная, так как содержит три карбоксильные группы:
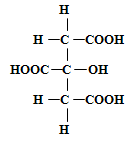
В чистом виде она представляет собой белое кристаллическое вещество, хорошо растворимое в воде и спирте. В состав её кристаллов входит одна частица воды, поэтому температура плавления водной кислоты 70-75°C и безводной 153°Cразлична. Лимонная кислота образуется как вторичный продукт при спиртовом брожении. К периоду технической зрелости содержание её в винограде увеличивается, в дальнейшем к моменту физиологической зрелости снижается.
Лимонная кислота широко применяется в разных отраслях промышленности, и, прежде всего в пищевой, где её используют в кондитерском производстве, при изготовлении безалкогольных напитков, в виноделии для подкисления малокислотных плодово-ягодных соков, для получения шампанского. Она также применяется в текстильном производстве для окраски и печатания тканей. Получают лимонную кислоту промышленным путём из отходов сахарного производства при помощи плесневых грибов, осуществляющих лимоннокислое брожение. Другим источником получения лимонной кислоты являются цитрусовые, а также отходы табачного производства и махорки.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() В ягодах незрелого винограда в свободном и связанном состоянии обнаружены в незначительных количествах и другие кислоты: янтарная (HOOCCH2 CH2 COOH), гликолевая (CH2 OHCOOH), щавелевая (HOOCCOOH∙2H2 O), глюкуроновая [COH(CHOH)4 COOH], фумаровая (COOHCH=CHCOOH), хинная [C6 H7 (OH)4 COOH], глицериновая (CH2 OHCHOHCOOH). К летучим кислотам относятся: муравьиная и уксусная. К ароматическим кислотам бензойного ряда относятся: n-оксибензойная, протокатеховая, ванилиновая, сиреневая, галловая, салициловая и гентизиновая. К ароматическим кислотам коричневого ряда относятся: кофейная, ферулевая, синаповая и кумаровая. Ко времени созревания винограда эти кислоты почти полностью исчезают, поэтому их трудно обнаружить в виноградном соке.
В ягодах незрелого винограда в свободном и связанном состоянии обнаружены в незначительных количествах и другие кислоты: янтарная (HOOCCH2 CH2 COOH), гликолевая (CH2 OHCOOH), щавелевая (HOOCCOOH∙2H2 O), глюкуроновая [COH(CHOH)4 COOH], фумаровая (COOHCH=CHCOOH), хинная [C6 H7 (OH)4 COOH], глицериновая (CH2 OHCHOHCOOH). К летучим кислотам относятся: муравьиная и уксусная. К ароматическим кислотам бензойного ряда относятся: n-оксибензойная, протокатеховая, ванилиновая, сиреневая, галловая, салициловая и гентизиновая. К ароматическим кислотам коричневого ряда относятся: кофейная, ферулевая, синаповая и кумаровая. Ко времени созревания винограда эти кислоты почти полностью исчезают, поэтому их трудно обнаружить в виноградном соке.
![]()
![]()
![]() Янтарная кислота (HOOCCH2 CH2 COOH) хорошо растворима в спирте и воде, хуже - в диэтиловом эфире; в бензоле, бензине и хлороформе - нерастворима. При нагревании до 150°C теряет воду и превращается в ангидрид.
Янтарная кислота (HOOCCH2 CH2 COOH) хорошо растворима в спирте и воде, хуже - в диэтиловом эфире; в бензоле, бензине и хлороформе - нерастворима. При нагревании до 150°C теряет воду и превращается в ангидрид.
Янтарная кислота содержится в винограде в незначительном количестве (от 0,2 до 0,4 г на 1 кг винограда). В незрелом винограде её больше. В процессе созревания количество её уменьшается. Янтарная кислота очень устойчивое соединение, она не подвергается окислению даже царской водкой, однако легко дегидрируется сукциндегидрогеназой с образованием фумаровой кислоты. Растворы янтарной кислоты имеют горько-солоноватый привкус.
![]()
![]()
![]()
![]() Фумаровая кислота (COOHCHCHCOOH) образуется путём дегидратации яблочной и дегидрированием янтарной кислот. В первом случае участвует фермент фумараза, а во втором - сукциндегидрогеназа. Фумаровая кислота была найдена в незрелом винограде.
Фумаровая кислота (COOHCHCHCOOH) образуется путём дегидратации яблочной и дегидрированием янтарной кислот. В первом случае участвует фермент фумараза, а во втором - сукциндегидрогеназа. Фумаровая кислота была найдена в незрелом винограде.
Диоксифумаровая кислота образуется из винной кислоты путём ей дегидрирования. Диоксифумаровая кислота существует в двух формах: в энольной и кетоформе в зависимости от применяемого реактива. Эти формы находятся в равновесии:
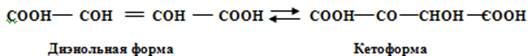
Диэнольная форма обладает сильными восстановительными свойствами. Диоксифумаровая кислота - неустойчивое соединение, в водных растворах даже при комнатной температуре распадается на CO2 и H2. Распад усиливается в присутствии железа и меди. В вине она появляется в результате окисления винной кислоты солями тяжёлых металлов, но быстро распадается в аэробных условиях, поэтому её трудно обнаружить в вине.
![]() Диоксифумаровая кислота участвует в обмене веществ при созревании винограда. В молекуле диоксифумаровой кислоты содержатся две вторичные оксигрупп (COHCOH), которые могут окисляться и восстанавливаться. Следовательно, эта кислота может функционировать в роли переносчика водорода. Диоксифумаровая кислота может служить промежуточным переносчиком водорода с субстрата на кислород воздуха, выполняя такую же функцию в биологическом окислении, как аскорбиновая кислота.
Диоксифумаровая кислота участвует в обмене веществ при созревании винограда. В молекуле диоксифумаровой кислоты содержатся две вторичные оксигрупп (COHCOH), которые могут окисляться и восстанавливаться. Следовательно, эта кислота может функционировать в роли переносчика водорода. Диоксифумаровая кислота может служить промежуточным переносчиком водорода с субстрата на кислород воздуха, выполняя такую же функцию в биологическом окислении, как аскорбиновая кислота.
Диоксифумаровая кислота в винограде содержится в незначительном количестве. Она служит катализатором окислительно-восстановительных процессов. Диоксифумаровая кислота легко окисляется оксидазой диоксифумаровой кислоты. Поэтому в винограде содержатся продукты её распада: мезоксалевая, гликолевая и глиоксалевая и щавелевая кислоты. Диоксифумаровая кислота играет важную роль в восстановительных процессах в виноделии. Она легко дегидрируется, отдавая два водорода для восстановления веществ, обусловливающих букет вина, при этом вкус и букет вина улучшаются.
![]() Гликолевая кислота (α-оксиуксусная) (CH2 OHCOOH) впервые была выделена в 1866 году из зелёного винограда Эрленмейером. Гликолевая кислота представляет собой бесцветные игольчатые кристаллы, легко растворяется в воде, спирте, эфире. Гликолевая кислота образуется из диоксифумаровой кислоты через оксипировиноградную кислоту. Гликолевая кислота легко окисляется оксидазой гликолевой кислоты с образованием глиоксалевой кислоты и H2 O2 . Образовавшаяся перекись водорода участвует в окислительно-восстановительных процессах, в частности окисляет глиоксалевую и щавелевую кислоты в муравьиную, углекислоту и воду. Все продукты окисления глиоксалевой кислоты были найдены в винограде и вине.
Гликолевая кислота (α-оксиуксусная) (CH2 OHCOOH) впервые была выделена в 1866 году из зелёного винограда Эрленмейером. Гликолевая кислота представляет собой бесцветные игольчатые кристаллы, легко растворяется в воде, спирте, эфире. Гликолевая кислота образуется из диоксифумаровой кислоты через оксипировиноградную кислоту. Гликолевая кислота легко окисляется оксидазой гликолевой кислоты с образованием глиоксалевой кислоты и H2 O2 . Образовавшаяся перекись водорода участвует в окислительно-восстановительных процессах, в частности окисляет глиоксалевую и щавелевую кислоты в муравьиную, углекислоту и воду. Все продукты окисления глиоксалевой кислоты были найдены в винограде и вине.
![]() Глюкуроновая кислота [COH(CHOH)4 COOH] представляет собой иглоподобные кристаллы. При нагревании с HCl распадается на фурфурол, CО2 и H2 O. В сусле и вине, полученном из винограда, поражённого грибком Ботритис цинереа, обнаруживается до 1,3 г/дм3 глюкуроновой кислоты. Такое увеличение обусловлено окислением глюкозы ферментами гриба.
Глюкуроновая кислота [COH(CHOH)4 COOH] представляет собой иглоподобные кристаллы. При нагревании с HCl распадается на фурфурол, CО2 и H2 O. В сусле и вине, полученном из винограда, поражённого грибком Ботритис цинереа, обнаруживается до 1,3 г/дм3 глюкуроновой кислоты. Такое увеличение обусловлено окислением глюкозы ферментами гриба.
Галактуроновая кислота представляет собой кристаллическое вещество; входит в состав пектиновых веществ винограда и вина. По химическим свойствам близка к глюкуроновой кислоте. В вине в связи с гидролизом пектиновых веществ содержание её увеличивается.