Курсовая работа: Магнийорганические соединения
В гексаметаполе (L) главная форма – RMgHal·2L с частично ионной связью Mg–С. В углеводородах RMgHal образуют структуры с мостиковыми атомами галогена, RMgF в эфире и ТГФ – димер с мостиковыми атомами F.
Соединения R2 Mg – бесцветные твердые вещества, обычно разлагающиеся при нагревании без плавления, для некоторых R2 Mg известны температуры плавления. Плохо растворимы в насыщенных углеводородах, лучше – в бензоле. Обычно кристаллизуются из полярных сред в виде комплексов с растворителем составов 1:1 или 1:2, однако в отличие от RMgHal растворитель может быть легко удален в вакууме. В кристаллическом состоянии R2 Mg (R = СН3 , С2 Н5 ) имеют структуру линейных полимеров с мостиковыми алкильными группами. В среде углеводородов R2 Mg представляют собой димеры или тримеры в эфире или ТГФ – сольватированные мономеры, однако при высоких концентрациях R2 Mg возможна их ассоциация. Связь Mg–С в растворенных R2 Mg обычно ковалентная однако в гексаметаполе она существенно ионизирована. Фактически комплексно связанный эфир входит в состав магнийорганического соединения. Кроме того, по эбуллиоскопическим определениям А. П. Терентьева гриньяров реактив имеет удвоенный молекулярный вес. При электролизе его эфирного раствора на катоде отлагается магний. Всё это дало основание Тереньтеву предложить для реактива Гриньяра такую структуру (контактная ионная пара):
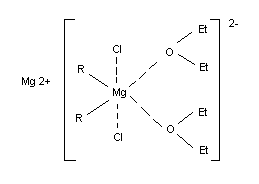
Эшби и Уокер (1967 г.) привели доводы в пользу того, что ассоциация гриньяровского реактива осуществляется галоидными мостами:
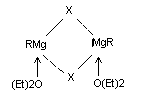
Однако такая структура не объясняет факта электропроводности и электролиза эфирных растворов гриньяровских реактивов с переносом Mg2+ на катод. Несмотря на сложную структуру реактивов Гриньяра, для описания всех их реакций вполне удовлетворяет формула RMgHal, которую обычно и применяют.
Получение
Получение RMgHal : главным образом в эфирном растворе из магниевых стружек и органического галогенида:
R-Hal + Mg → R-Mg-Hal
При этом раствор органического галогенида в диэтиловом эфире медленно, при перемешивании, прибавляют к суспензии Mg этом же растворителе. Во многих случаях (особенно при работе с АrНаl) магний активируют, для чего в реакционную смесь добавляют I2 , ВrСН2 СН2 Вr или C2 H5 Br. Для синтеза RMgНа1 из СН2 =СННаl и АrСl вместо диэтилового эфира применяют ТГФ или другие циклические эфиры, а также эфиры ди- и триэтиленгликоля. Эфир полностью обычно не удаляется, и RMgHal, доведенные до постоянного веса в вакууме при 100° С, представляют собой смесь MgHal2 и [R2 Mg]n ; в твердом виде выделяются как комплексы с растворителем состава 1:1 или 1:2. RMgHal, полученные в углеводородах, дают осадок MgHal2 и растворимое металлоорганическое вещество, которое в твердом виде отвечает составу R3 Mg2 Hal.
Активность RНаl уменьшается в ряду: R-I > R-Вr > R-Сl.
При получении реактива Гриньяра на практике применяют RВr, т.к. RСl мало реакционноспособен, а реакции с RI сопровождаются побочными процессами в большей степени, чем с бромидами. В случае вторичных и особенно третичных RI наблюдается отщепление НI с образованием олефина. Другая побочная реакция, которая часто сопровождает синтез алкилмагнийгалогенидов – образование углеводородов (реакция Вюрца - Гриньяра):
R'Наl + RМgНаl–> R–R' + МgHal2
В присутствии каталитических количеств солей переходных металлов (например, Со(II), Ni(II), Cu(II) и др.) образуется обычно R–R (реакция Хараша). Реакция из гетеролитической становится гомолитической из-за первоначального образования RCoHal, гомолизующегося на радикал и радиколообразный галогенид переходного металла:
RCoHal → R∙ + ∙CoCl
Получение R2 Mg : осаждением диоксаном из эфирного раствора RMgHal; реакцией с ртутьорганическими соединениями:
R2 Hg + Mg –> R2 Mg + Hg.
Реакции
Магнийорганические галогениды чрезвычайно реакционноспособны. Наиболее широко их применяют в реакциях с соединениями, содержащими поляризованную кратную связь (например, С=О, С≡N, С=S).
1. Соединения RMgHal разлагаются выше 100°С по типу -элимиминирования, например:
2RCH2 CH2 MgHal –> 2RСН=СН2 + MgH2 + MgHal2 .
2. Окисление RMgHal первоначально приводит к ROOMgHal, затем образуются ROMgHal.
RMgHal + O2 → ROOMgHal → ROMgHal
3. При действии органические соединения с активным атомом водорода RMgHal дают RH. Эту реакцию (при R = СН3 ) используют для определения активного Н в органических соединениях (метод Церевитинова). Измеряя объём метана, выделившегося при взаимодействии определённого количества соединения с подвижным водородом, можно вычислить число молей активного водорода в образце. Если известна молекулярная масса, то можно определить число активных водородов в молекуле.
RMgHal + C2 H5 O∙∙∙H → CH4 + C2 H5 OMgHal
4. Магнийорганические соединения RMgHal разлагаются под действием воды и кислот, восстанавливаются водородом при нагревании до RH, MgH2 и MgHal2 .
RMgHal + H2 O → RH + Mg(OH)Hal
RMgHal + H2 → RH + MgH2 + MgHal2
5. С галогенами образуют RHal и MgHal2 , с S (и последующим гидролизом) – RSH, с SO2 – RSO2 MgHal, с СО2 – соли карбоновых кислот.