Курсовая работа: Малахит
Следовательно, запись (CuOH)2CO3 – основная соль, дигидроксикарбонат меди(II) – наиболее полно отражает состав малахита.
Рассмотрим реакцию разложения малахита:
(CuOH)2CO3 →2CuO +H2O + CO2
В зависимости от этапа изучения химии она может быть описана:
а)
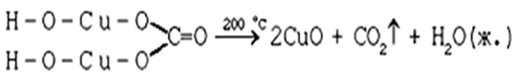
б) на ионно-структурном уровне:
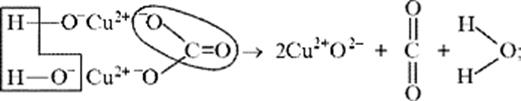
в) на электронно-ионном уровне:
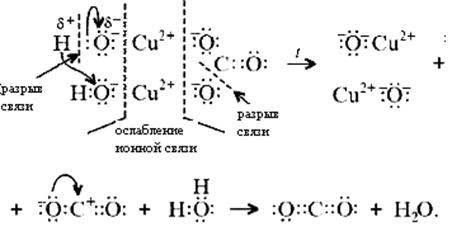
Знание свойств карбонатов и нерастворимых в воде оснований позволяет утверждать, что малахит будет растворяться в кислотах:
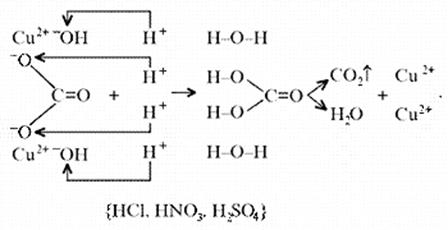
Примечание. Ион Н+ присоединяется к кислороду в составе гидроксид- и карбонат-ионов по донорно-акцепторному механизму:
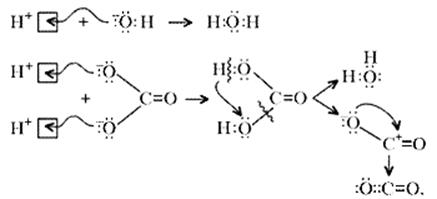
Малахит можно рассматривать как производное гидроксида меди(II), в котором часть гидроксильных ионов замещена на карбонат-ионы (таково, собственно, определение понятия «основная соль»). Кроме реакции с кислотами при определенных условиях он может реагировать с кислотными оксидами. Мысль совершенно невероятная, учитывая нерастворимость малахита в воде – главнейшее условие взаимодействия кислотных оксидов с основаниями, точнее со щелочами. Однако имеет место реакция:
(CuOH)2CO3 + CO2 = CuCO3)2 + Н2О
«Химические события» соответствуют такому механизму:
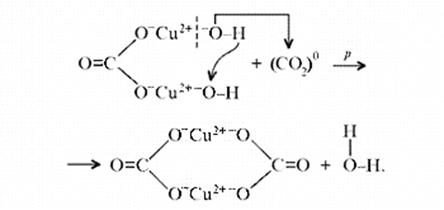
Обратим внимание на образование средней соли. Теперь считается доказанным, что карбонат меди(II) можно помещать в список солей угольной кислоты.[11]
Малахит, как известно, не растворяется в воде, но может подвергаться гидролизу (из-за гидролиза, собственно, невозможно получить осадок среднего карбоната меди):
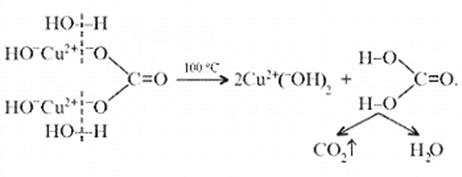
Из-за способности ионов меди образовывать комплексные ионы малахит растворяется, в частности, в карбонатах щелочных металлов:
(CuOH)2CO3 + K2CO3 = K2[Cu(CO3)2] + Cu(OH)2.
темно-синий
Теоретическим обоснованием этому может служить запись:
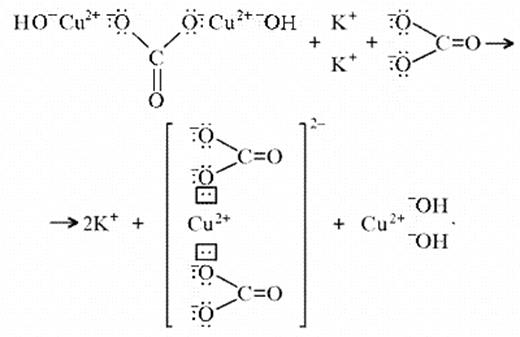
Схема генетических связей: образование и свойства малахита.
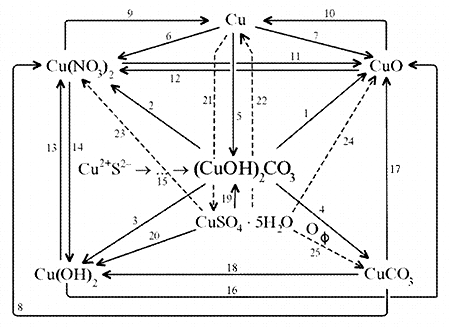 |
1. Разложение малахита.
2. Растворение малахита в кислотах.