Курсовая работа: Металлургические способы получения лантаноидов
Содержание в электролите значительного количества оксихлоридов редкоземельных элементов затрудняет проведение электролиза. Оксихлориды не разлагаются током. Однако в их присутствии часть металла выделяется на катоде в тонкодисперсном состоянии (в виде металлического тумана). Тонкие частицы металла всплывают на поверхность ванны и окисляются. Попадая к аноду, частицы металлического тумана хлорируются с образованием хлоридов, которые растворяются в расплаве. Явление металлического тумана приводит к сильному снижению выхода по току. Слишком высокие и очень низкие плотности тока так же содействуют выделению металла в мелкодисперсном состоянии.
Расстояние анода от поверхности расплавленного металла поддерживают 30—35 мм при глубине погружения анода в ванну 100—110 мм [2].
Электролиз ведется при температуре ванны 900—1100°С в зависимости от температуры плавления электролита и мишметалла. Повышенное содержание окислов или оксихлоридов в ванне ведет к загустеванию электролита.
В процессе электролиза на аноде выделяется хлор. Поэтому ванна должна иметь хороший вентиляционный отсос.
После заполнения тигля ванна опрокидывается, и содержимое выливается в стальные изложницы, нагретые до 500—550°С. При этом солевой расплав защищает металл от окисления.
Другая конструкция электролизера показана на рис. 2. Ванна футерована магнезитом, причем катод железный, что несколько повышает содержание железа в металле.
Получаемые мишметалл содержат 94—99% редких земель и ряд примесей: углерод, кальций, алюминий, до 1% Si, от 1 до 2,5% Fe и др [2].

Рис. 2. Ванна для электролитического получения технического мишметалла со стальным тиглем, футерованным магнезитом: 1 — стальной тигель; 2 — магнезитовая футеровка; 3 — стальной катод; 4 — графитовый анод; 5 — тележка; 6 — расплавленный мишметалл; 7 — расплавленный электролит
Чистоту металлов можно повысить применением при изготовлении электродов металлов, не взаимодействующих с лантаноидами (молибден и особенно тантал), использованием для футеровки тигля чистых окислов магния или бериллия, а также проведением электролиза в атмосфере инертного газа.
Исследователями в лабораторных условиях разработаны технологические условия электролитического получения празеодима, иттрия, самария и гадолиния.
Электролиз проводили в графитовом стакане, служащем анодом, в центре которого устанавливали молибденовый стержень — катод. В дне ванны вытачивалось углубление, куда устанавливали фарфоровый тигель — приемник жидкого металла.
При температуре электролита 1050—1100°С и катодной плотности тока 20—30 А/см2 выход по току и извлечение составляют 40—50 и 80—85% соответственно. В процессе электролизав ванну периодически необходимо добавлять хлорид празеодима из расчета 40—45% выхода по току.
Электролитическое выделение иттрия, гадолиния и самария может быть успешно осуществлено в ванне того же типа, но с применением жидкого цинкового катода. В этом случае, в фарфоровом тигле, помещенном в центре графитового стакана, находится расплавленный цинк—катод. Ток к жидкому катоду подводится молибденовым стержнем, изолированным от соприкосновения с электролитом фарфоровой трубкой.
При температуре электролита 800°С и катодной плотности тока 2 A/см2 выход по току для иттрия и гадолиния составляет до 95%, а для самария 65%. Общее извлечение металлов в сплав с цинком достигает 90%. [2]
Содержание самария в сплаве с цинком может быть доведено до 10%, гадолиния до 13%.
Цинк легко отделяется от редкоземельных металлов отгонкой в вакууме при температуре 900°С.[2]
1.2 Металлотермические методы получения лантаноидов
Различные исследователи изучали восстановление галоидных солей (хлоридов, фторидов), а также окислов лантаноидов щелочными металлами, алюминием, магнием и щелочноземельными металлами.
Из теплот и свободной энергии образования галогенидов лантаноидов и распространенных металлов-восстановителей, можно заключить, что для хлоридов подходящими восстановителями могут служить натрий и кальций, а для фторидов — кальций. При восстановлении хлоридов натрием, однако, не удалось получить редкоземельные металлы в виде слитка, хорошо отделяющегося от шлака.
При восстановлении галогенидов магнием и алюминием получаются сплавы редкоземельных элементов с восстановителями, причем выход в сплав недостаточно высокий. Магний может быть отделен от редкоземельного металла вакуумной дистилляцией при температуре выше температуры плавления лантаноидов, но алюминий достаточно полно этим способом не удаляется.
Лучшие результаты в отношении выхода, выплавки слитка и чистоты металлов получены при восстановлении галогенидов кальцием.
Этим методом могут быть получены все лантаноиды за исключением самария, европия и иттербия, восстановление которых протекает только до низших галогенидов. Для получения самария, европия и иттербия разработан метод восстановления их окислов лантаном, с одновременной вакуумной возгонкой этих металлов.[3]
1.2.1 Восстановление галоидных солей кальцием
Восстановление галогенидов кальцием необходимо проводить при температурах выше плавления лантаноидов с тем, чтобы обеспечить выплавку металлического слитка. При этом шлак должен находиться в расплавленном состоянии. Это определяет различия в условиях восстановления таких сравнительно легкоплавких металлов, как La, Ce, Pr, Nd (температура плавления лежит в интервале 800—1050°С) и металлов иттриевой группы, плавящихся в интервале температур 1350—1650°С.
Легкоплавкие лантаноиды (La, Се, Рr, Nd) могут быть получены восстановлением хлоридов или фторидов кальцием. Восстановление безводных хлоридов этих элементов с получением металлов высокой чистоты производится в стальных бомбах небольшого размера, футерованных чистой окисью магния или доломитной смесью окисей кальция и магния (рис. 3).
Максимальная температура восстановления 1100°С. При этой температуре MgO практически не реагирует с лантаноидами. Однако при более высоких температурах происходит частичное восстановление окиси магния расплавленным редкоземельным металлом и переход магния в сплав. Кальций высокой чистоты (очищенный дистилляцией в вакууме) в виде зерен размером ~0,6—1 мм перемешивается с хлоридом лантаноида в атмосфере сухого аргона в специальной камере. Смешивание в сухом аргоне необходимо для предотвращения поглощения влаги хлоридом и азота кальцием.
Кальций вводится в смесь с избытком ~15—20% против теоретически необходимого количества. При проведении процесса в малых масштабах теплоты реакции недостаточно для обеспечения расплавления образующегося металла и шлака.
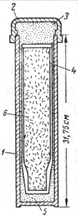
Рис. 3. Реакционная бомба для восстановления хлоридов лантаноидов кальцием: 1 — стальная трубка диаметром 6,35 см; 2 — стальная крышка; 3 — набивка из СаО; 4 — футеровка из спеченного огнеупора; 5 — набивка СаО; 6 — шихта