Курсовая работа: Методы определения хлорид-ионов
Введение
Защите окружающей среды от возрастающей антропогенной нагрузки в настоящее время уделяется все большее внимание во всем мире. Развитие промышленности, в том числе и химической, увеличение добычи ископаемого сырья, расширение использования транспорта сопровождается поступлением в окружающую среду больших количеств различных загрязняющих веществ.
Сильное загрязнение окружающей среды (воды, воздуха, почвы) приводят к возникновению неблагоприятных последствий: нарушению нормальной жизнедеятельности биосферы, изменению климата, исчезновению многих видов растений и животных, ухудшению здоровья населения.
Для предотвращения или снижения загрязнения издаются природоохранительные законы и проводятся различные мероприятия – технологические, санитарно-технические, технические, правовые, медицинские и т.п. В основе всех мероприятий лежит контроль за содержанием вредных веществ, который регламентируется санитарно-гигиеническими нормативами – ПДК. Контроль необходим для получения информации об уровне загрязнения, а также об источниках выбросов, причинах и факторах, определяющих загрязнение. Полученные данные позволяют выбирать или проводить защитные, оздоровительные мероприятия и следить за их выполнением.
К качеству контроля предъявляются требования надежности и точности, применяемые методы должны быть достаточно чувствительны и избирательны. Независимо от техники выполнения надежность результатов анализа зависит от учета возможных химических, фотохимических и биохимических превращений загрязняющих веществ в разных средах, а также возможности миграции их из одной среды в другую. Данные о загрязнении одной среды должны увязываться с данными о загрязнении другой среды.
1 . Распространение хлорид-иона
Хлорид-ион образуется в результате растворения и сольватации ионных солей, содержащих анион хлора (хлориды). Следовательно, существование хлорид-иона возможно только в водных растворах. В почвах хлорид ион может также содержатся в составе кристаллических солей. В природе хлор представленный хлорид ионом имеет значительное распространение: 0,02% от массы земной коры. Для сравнения это столько же, сколько и углерода или в 10 раз больше чем свинца. Самые распространенные минералы, содержащие хлорид ион: галит NaCl, сильвинит NaCl*KCl, карналлит KCl*MgCl2 . Хлориды тяжелых металлов нерастворимы, хлориды щелочных и щёлочноземельных металлов растворимы все. Значительная растворимость хлоридов обусловила их распространение на планете. Основным местонахождением хлоридов является Мировой океан. По содержанию солей воды мирового океана являются хлоридно-натриевыми. Средняя концентрация хлорид-иона составляет 546 ммоль/л (19 г./л). Значительное содержание хлоридов во внутренних водоёмах явление редкое. Оно колеблется в пределах 5–80 мг/л. Повышенное содержание хлоридов объясняется загрязнением водоема сточными водами некоторых производств. Однако тому причиной может быть и выщелачивание материнской породы содержащей хлоридные соли.
Содержание хлорид иона в поверхностных слоях почвах, также не может достигать значительных величин вследствие интенсивного вымывания хлоридов под воздействием атмосферных осадков. Однако возможно присутствие значительных концентраций хлоридов в следующих случаях:
– вследствие засоления почв в результате подъёма высокоминерализованных подземных вод;
– в результате постоянного притока вод с последующим испарением жидкости.
Отсюда два различных местанахождения хлоридов. В первом случае это жидкость влажной почвы, а во втором растворённые хлориды образуют включения кристаллических солей в грунте.
2. Методы определения хлорид-иона
2.1 Общие положения
Необходимость определения хлорид-ионов возникает при анализе различных веществ, природных, питьевых и сточных вод. Контроль содержания хлорид-ионов требует различных уровней – от макроконцентраций до 10-7 % в особо чистой воде. Существующие государственные стандарты (ГОСТы), регламентируют, какое веществом каким методом и с помощью какого оборудования нужно определять. Современные нормативные документы, регламентирующие процедуру контроля содержания загрязнителей в водах различного происхождения, разрешают использование химических, физико-химических и физических методов анализа. Основная масса лабораторий, проводящих мониторинг вод, не всегда располагает современным оборудованием для реализации физических методов анализа, позволяющих быстро, правильно и точно определять концентрацию загрязнителей. Наиболее массово по-прежнему представлены химические методы. Возможности разработанных на основе этих методов методик определения содержания в воде неорганических загрязнителей не всегда удовлетворяют требованиям ГОСТ, особенно при анализе вод природного происхождения. Многие загрязнители в воде можно обнаруживать разными способами, на разном оборудовании, но разные методы анализа дают различную погрешность, некоторые могут не учитывать какие-либо мешающие факторы. Определение хлоридов в этом отношении имеет ряд преимуществ. Их содержание редко пускается до микроконцентраций, и поэтому основные методики определения хлоридов всё ещё остаются методами «мокрой» химии. Однако в последнее время инструментальные методы применяются все чаще. Инструментальные методы позволяют автоматизировать анализ, сделать его экспрессным, значительно уменьшают расход вспомогательных реактивов. Определение хлоридов можно проводить такими методами:
– титриметрия;
– потенциометрия;
– нефелометрия;
– кондуктометрия;
Титриметрическое определение хлоридов может выполняться как химическими так и инструментальными методами анализа.
2.2 Химические методы определения хлорид иона
2.2.1 Требования к титриметрическим методам определения
???????????????? ??????????? ????????, ???????? ?? ???????? ??????????? ??????? ??????????????? ??????????. ?? ??? ??????? ???????????????? ?????????? ??????? ????????? ? ???????? ???????. ? ???? ???????? ???????? ?????? ????????? ???????, ??????????????? ???????????? ????????. ??????? ?????? ????????? ?????? ?? ????????? ? ??? ???????? ?????????. ???????????? ?????? ?????? ???? ??????????? ????????????? ? ???????? ?????????? ??????, ??? ??????????? ???????????? ?????????. ? ???? ?? ?????????? ????? ??????????? ?????????? ???????? ????? ?????????? ? ??????? ??????????. ???????, ??????? ????????? (???????????) ?????? ???? ???????? ??? ?????????? ????????? ?????, ????? ????????? ??????????? ?? ?????????.???????????? ????????? ??????? ????????? ?????????? ?? ???????? ??????????? ?????????. ?????, ???????????? ??????? ??????? ???????, ???????? ??????????????. ???????????????? ???????? ?? ?????????? ???????? ?????????? ??????? NH4 SCN (??? ????? KSCN) ? ?????? ??? ??????????? ?????? ?1- ? ?????????????? ? ?????? ?????????. ????????????? ?????????????????? ????? ??????????? ??????????? ?? ??????????? ????????? ???????? ??????????????????. ? ????????? ?????????? ??????? ??????? ????? (I) Hg2 (NO3 )2 .2.2.2 Аргентометрия ???????? ????????????? ?????, ?????????? ?? ???????? ????????? ????? ????????? ????????? ??????? ? ???????????? ??????????????? ???????????: Cl- +Ag+ = AgCl↓ ??? ???? ?????????? ??????? ??????? ???????. ???? ?? ??????????? ???????? ?? ?????????? ???????, ?? ?????????? ????????? ??????? ?????? (??? ?????).??? ????????? ?????? ????????????? ??????? ???????? ????? ?????? ??????????. ? ???????? ??????? ?????????? ?????? ?????????? 10,00 ?? 0,1 ?. ???????? ??????? ?????? 0,1 ?. ????????? ??????? ??????? (??? ????? ????????? ?????? ????????).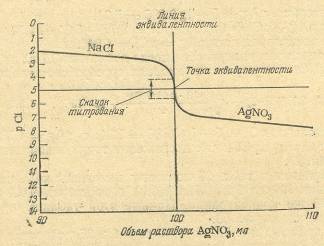 ??????? 2.1 ? ?????? ?????????? ???????? NaCl ????????? AgNO3 ?? ?????? ?????????? ???????????? ??????-????? ? ???????? ????? ????? ???????????? ??????? ??????, ?.?. 0,1 ????/? ??? [Cl- ]=l0-1 .????????? ????????????? ???????? ???????????? (??? ??????????) ???????????? ??????-????? ????? ??l, ????? ????????: ?Cl = ? lg [Cl- ] = ? lg l0-1 = 1. ????? ? ?????????? ???????? ??????? ?????? ????? ?????????? 9,00 ?? ???????? ??????? ??????? ? 90% ??????-????? ????? ????????, ???????????? ?? ? ???????? ?????????? ? 10 ??? ? ?????? ????? 10-2 ????/?, ? ??1 ????? ????? 2. ????????? ?? ???????? ?PAgCl=10-10 , ???????????? ????? ??????? ??? ???? ????????: [Ag+] = 10-10 /[?1- ] = 10-10 /10-2 = 10-8 ????/?,???pAg= ? lg[Ag+ ] = ? lgl0-8 = 8. ??????????? ??????? ????????? ??? ????????? ????? ??? ?????????? ?????? ??????????. ? ????? ??????????????? pCl=pAg= 5 (??. ????. 2.1). ??????? 2.1 ? ????????? ??l ? pAg ??? ?????????? 10,00 ?? 0,1 ?. ???????? ??????? ?????? 0,1 ?. ????????? ??????? ???????
??????? 2.1 ? ?????? ?????????? ???????? NaCl ????????? AgNO3 ?? ?????? ?????????? ???????????? ??????-????? ? ???????? ????? ????? ???????????? ??????? ??????, ?.?. 0,1 ????/? ??? [Cl- ]=l0-1 .????????? ????????????? ???????? ???????????? (??? ??????????) ???????????? ??????-????? ????? ??l, ????? ????????: ?Cl = ? lg [Cl- ] = ? lg l0-1 = 1. ????? ? ?????????? ???????? ??????? ?????? ????? ?????????? 9,00 ?? ???????? ??????? ??????? ? 90% ??????-????? ????? ????????, ???????????? ?? ? ???????? ?????????? ? 10 ??? ? ?????? ????? 10-2 ????/?, ? ??1 ????? ????? 2. ????????? ?? ???????? ?PAgCl=10-10 , ???????????? ????? ??????? ??? ???? ????????: [Ag+] = 10-10 /[?1- ] = 10-10 /10-2 = 10-8 ????/?,???pAg= ? lg[Ag+ ] = ? lgl0-8 = 8. ??????????? ??????? ????????? ??? ????????? ????? ??? ?????????? ?????? ??????????. ? ????? ??????????????? pCl=pAg= 5 (??. ????. 2.1). ??????? 2.1 ? ????????? ??l ? pAg ??? ?????????? 10,00 ?? 0,1 ?. ???????? ??????? ?????? 0,1 ?. ????????? ??????? ???????| Прибавлено раствора AgNO3 , мл | [С1- ] | [Ag+ ] | рСl | pAg |
| 0 | 10-1 | 0 | 1 | - |
| 9.00 | 10-2 | 10-8 | 2 | 8 |
| 9.90 | 10-3 | 10-7 | 3 | 7 |
| 9.99 | 10-4 | 10-6 | 4 | 6 |
| 10.00 (точка эквивалентности) | 10-5 | 10-5 | 5 | 5 |
| 10,01 | 10-6 | 10-4 | 6 | 4 |
| 10,10 | 10-7 | 10-3 | 7 | 3 |
| 11,00 | 10-8 | 10-2 | 8 | 2 |
| 20,00 | 10-9 | 10-1 | 9 | 1 |
Ag+ + Cl- → AgClmAgCl + n Ag+ ( изб ) → (AgCl)m Ag+ n (AgCl)m Agn + + Ind- → [(AgCl)m Ag+ n ] Ind- ?????????? ???????? ? ??????????? ???????????? ???????? ? ??????????? ?????. ??? ?????????? ???????????? ????? ???????? ???????????, ?????????? ???????? (HInd), ???????????? ????? ?????????? ?????????? ??? ??????????? ????????. ??????? ???????????? Ind-????? ?????????? ????? ?????. ? ???????? ???????? ?????????? Ag2 O. ? ???????? ?????? ????? ?????? ??????? ? ??????????? ?????? ???????????: ?????????????????? ? ??????. ?????????? ? ?????? ?????? ??????? ?????????? ?? ?????????? ? ??????????? ?????????, ??? ??? ???? ??????????? ????? ??????????? ? ??????????? ??????????????? ?????, ????????????? ????? ? ???????????? ??????? ??????????? ? ???????????? (Al3+ , Fe3+ ? ??.).? ?????? ????? ? ?????? ???????? ?????. ????? ???? ??????? ????? ???????? ?? ????? ? ????????? ????????????. ??? ??????????? ??????? ???????? ?????????? ????? ???????????? ???????? (?? 25 ??), ????????? ?? ? ?????????? ?????, ?????????? ?? 5 ?????? ???????? ???????????? ? ??????? ??????????? ????????? AgNO3 , ?????????? ???????????. ?? ???? ??????????? ?? ?????? ???????? AgNO3 ????????? ????? ???????. ?????? ????? ??????????????? ??????????? ????????? ?????????? ??????????? ?????? AgCl. ? ???? ?????? ??????? ??? ????? ??????????? ? ?????????, ?????? ??????????? ?????????? ?????, ?????????? ???????????, ????? ????? ?????? AgCl ???????????? ? ??????? ????. ?????????? ????????? 3 ? 4 ???? ?, ??????? ??? ?????????? ??????????, ????????? ?????????? ???????.
2.2.3 Роданометрия ????????????????? ????? (????? ?????????) ????????????????? ??????? ??????? ?? ?????????? ? ???????? ????????? ???????????? ????????, ??????????? SCN- -????: Ag+ + SCN- → AgSCN ? ???????? ??????????? ????????? ??????????: ??? ??????????? ????? ??????? ???????; ??? ??????????? ??????????? ? ?????? ????? ? ?????? ??????? ? ??????? ???????.????????????????? ??????? ?????????? ??? ??????????? ???????-????? ? ??????? ? ?????????? ???????. ? ???????????? ? ???????? ?????????? ??? ??????????? ????? ???????????????. ????????? ?????????? ??????? ??????-?????????? ???????.????? ????????? ???????? ????? ?????????? ?? ????????? ? ??????? ????. ????????????????? ????? ???????? ??? ??????????? ????????, ????????, ???????, ????????? ? ????? ???????.????? ???????? ??? ?????????? ?????? ????????? ??? ??? ?????? AgSCN ??????????? ? ????????. ??? ??????????? ?????? ?????? ????? ??????? ??? ??????? ?????????? ???????, ??????? ?????????? ? ????????, ? ?????????????? ??????????? ??????????? ? ???????????? ??????, ??? ??? ?????????? ? ????????? ?????? ?????? ????????? ?? ?????? ???? ??? ? ??????????? ????????????? ???????????. ?????? ???? (??2+ , ??2+ ? ??.), ???????? ??????????? ?? ?????? ????, ? ??????????? ??????? ?? ?????? ??????????? ?? ?????? ?????????.??????????? ?1- -????? ?? ?????? ????????? ???????? ?? ?????????? ?????? ????????? ??????????. ??????-???? ??????? ???????? ???????????? ??????? ???????????? ???????? AgNO3 , ??????? ? ????????. ????? ????????????? ?? ?????????? ? ??????? ? ???????? ??????? AgNO3 ??????????? ????????? NH4 SCN ? ??????????? ??????-?????????? ??????? ? ???????? ??????????. ?? ???????? ??????????? ???? ?????????? ?????????? ????? ???????? AgNO3 , ???????????????? ?? ????????? ?1- ????? ???????, ??????????????? ????????? ??? ???????: Ag+ + Cl- → AgClAg+ + SCN- → AgSCN3 SCN- + Fe3+ → Fe(SCN)3 ?????? ? ??? ??????, ????? ??????? Ag+ ????? ?????????? ?????????, ??????? SCN – ????????, ????? ????, ? ??????? ? AgCl: AgCI+ SCN- ↔ AgSCN + ?l- ??? ??? ??????? ??????? (?PA g SCN = 10-12 ) ????? ?????????, ??? ?????? ??????? (?PAg Cl =. 1,7*10-10 ), ?? ????????? ?????????? ?????????? ????? ???????.? ?????? ?????????? ????????? [C1- ]/[SCN- ] ????? ????????? ?PAg Cl /?PAg SC N . ?????????????: [Cl- ]/[SCN- ] = ?PAg C / ?PA g SCN =
2.2.4 Меркуриметрия ????? ??????? ?? ?????????? ? ???????? ???????? ???????? ????? ????? (II). ??? ?????????????? Hg2+ ? ?????? ?????? ?????????? ????? ???????????????? ??????????: Hg2+ + Cl- → [HgCl]+ ????? ?????????? ????? ???????????????, ? ????????? ???????? ?????????? ?????????? ?g2+ -????, ??????? ???????????? ??? ?????? ???????????????? ??????????, ??????????? ? Hg2+ ??????????? ??????????.
В качестве стандартных растворов для определения галогенидов, цианидов и роданидов применяют нитрат или перхлорат ртути(II), а для определения ионов хорошо диссоциирующих солей ртути – роданид аммония.
В меркуриметрии в качестве индикаторов применяют нитропруссид натрия, дающий бесцветный осадок с Hg2+ , дифенилкарбазон, образующий синий осадок, р-нитрозо-нафтол, внутрикомплексное соединение которого с Hg2+ красного цвета. И.С. Мустафин и О.В. Сиванова в 1964 г. предложили для этой же цели применять нитрозооксин в смеси с красителем кислотным синим антрахиноновым; последний прибавляется в качестве светофильтра. Такой индикаторный раствор, названный авторами гидрон III, при избытке галогенидов окрашен в зеленый цвет, переходящий в красный при избытке Hg2+ . Индикатор позволяет работать с 2,5*10-3 н. раствором Hg2+ и определять, например, 0,03 мг хлоридов в 10 мл титруемого раствора.
Меркуриметрический метод широко применяется благодаря многим преимуществам по сравнению с аргентометрическими методами.
1. Меркуриметрический метод позволяет вести прямое определение анионов в кислой среде.
2. Этот метод применяется не только для определения галогенидов, цианидов и роданидов, но и для определения ионов окисной ртути.
3. Многие ионы, мешающие определению по методу Мора и Фольгарда, не оказывают влияния на точность определений с помощью нитрата или перхлората окисной ртути.
4. Соединения ртути являются менее дефицитными, чем соли серебра, и легко регенерируются.
Меркуриметрическое определение хлоридов выполняется методом прямого титрования анализируемого раствора раствором нитрата ртути (ІІ) в присутствии индикатора нитропруссида натрия или дифенилкарбазона. Титрование ведётся до появления сине-фиолетового окрашивания.
--> ЧИТАТЬ ПОЛНОСТЬЮ <--