Курсовая работа: Міжпредметні зв’язки на уроках хімії при розв’язуванні хімічних задач
Зручний спосіб компенсації впливу матриці, а також рішення проблем, пов'язаних з втратами речовини в ході складного аналізу, – використовування внутрішнього стандарту. Метод полягає в наступному. Перш ніж визначати речовину А, до що містить його зразка додають відому кількість речовини B. Кількості А і B визначають по одній і тій же методиці. Встановивши співвідношення між знайденою і відомою кількостями B, коректують отримане при аналізі кількість А. Внутрішній стандарт повинен бути відсутній в початковому зразку і бути хімічним аналогом визначуваної речовини. Наприклад, для визначення натрію в плазмі крові методом полум'яної емісійної спектроскопії як внутрішній стандарт часто використовують літій, оскільки він хімічно аналогічний натрію і в крові звичайно відсутній.
В методі доданих стандартів для приготування стандартів порівняння використовують сам досліджуваний зразок. Припустимо, що ми хочемо визначити вміст натрію в плазмі крові. Початковий зразок ділять на декілька частин, наприклад на три. До однієї з них нічого не додають, до двох іншим додають відомі кількості визначуваної речовини (в даному випадку Na), так що його концентрація стає на 100 і 200 ммоль/л більше, ніж в початковому зразку. Далі по одній і тій же методиці визначають Na у всіх частинах зразка і будують графік залежності величини, що виміряється, від приросту концентрації. З графіка визначають концентрацію натрію в початковому зразку.
Рівноважні і кінетичні вимірювання.
На мал. 2 графічно представлений хід хімічної реакції:
Визначувана речовина + Реагенти ![]() Продукти
Продукти
Спочатку концентрація лінійно міняється в часі, потім зміна стає все більш повільною, і, нарешті, концентрація виходить на горизонталь – система досягає рівноваги.
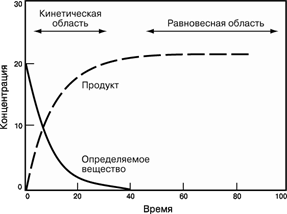
Мал. 2. ХІД ХІМІЧНОЇ РЕАКЦІЇ , представлений у вигляді графіка залежності концентрації реагенту від часу.
Хоча вважається, що багато хімічних реакцій йдуть «до кінця» (до повного вичерпання початкових речовин), насправді жодна з них не протікає тільки в одному напрямі. Хімічна реакція йде до тих пір, поки концентрація всіх що беруть участь в ній речовин не перестає мінятися, тобто поки система не досягне рівноваги. В цьому стані концентрація деяких речовин може бути дуже малий, але все таки вона не рівна нулю. Реакція не припиняється, просто швидкість прямої реакції (Реагенти ? Продукти) стає рівній швидкості зворотної (Продукти ? Реагенти), при цьому відбувається швидке взаємне перетворення реагентів і продуктів реакції, так що ніякої сумарної зміни концентрацій немає.
Аналітичні визначення можна проводити в хімічних системах, що знаходяться як в рівноважному, так і в нерівноважному станах. В першому випадку концентрації речовин не міняються, тому тривалість аналізу неістотна і не впливає на вибір методики. Рівноважні концентрації речовин пов'язані один з одним через константу рівноваги. Для хімічної реакції aA + bB ![]() cC + dD ця константа рівна
cC + dD ця константа рівна
![]()
де в квадратних дужках вказані мольні концентрації відповідних речовин, а показники ступеня рівні стехіометричним коефіцієнтам рівняння хімічної реакції. Константи рівноваги реакцій, що використовуються в аналітичній хімії, змінюються від 1 до 10100 і більш. Багато методів аналізу засновано на визначенні стану рівноваги. Можна навести як приклад дані нижче класичні методи – гравіметрію і титрування.
При аналізі нерівноважних систем визначають зміну концентрації реагуючих речовин в часі, тобто швидкість реакції. Вона задається виразом:
![]()
де до – константа швидкості, [A], [B], [C] – мольні концентрації речовин А, B, З, сума x , у , z – порядок реакції. Які саме хімічні речовини фігурують в рівнянні швидкості такої реакції і з якими ступенями входять їх концентрації, залежить від механізму хімічної реакції. При нерівноважних визначеннях потрібно встигнути провести вимірювання за достатньо малий (в порівнянні з тривалістю самої реакції) час, так щоб концентрації реагентів не змінилися. Визначення, засновані на вимірюванні швидкості реакції, можуть бути виконаний в дуже короткий час від початку реакції (іноді декілька секунд), оскільки не потрібно чекати, коли система досягне рівноваги. Якщо визначувана речовина – каталізатор, то вимірювання слід проводити до досягнення рівноваги, оскільки каталізатор змінює тільки швидкість реакції, але не положення рівноваги.
Застосування кінетичних вимірювань в аналітичній хімії не обмежується методами аналізу, заснованими на вимірюванні швидкості реакції. В основі багатьох аналітичних методів, наприклад флуоресцентного аналізу, амперометрії, хроматографії, лежать кінетичні процеси, хоча аналізуються системи, що знаходяться в стані рівноваги. Для одержання остаточних висновків і підвищення вірогідності застосовуються методи математичного аналізу і математичного моделювання.
Розділ ІІ
2.1 Міжпредметні зв’язки при розв’язуванні хімічних задач
«Рішення задач – визнаний засіб розвитку мислення, яке легко поєднується з іншими засобами і прийомами навчання» (Цитович І.К.).
При вивченні курсу хімії велика увага приділяється формуванню уміння учнів вирішувати експериментальні і розрахункові задачі.
Рішення задач сприяє розумінню учнями хімічних теорій, законів, встановленню зв'язку між явищами, причиною і слідством, узагальненню і закріпленню знань, розвитку логічного мислення, навиків самостійної роботи.
Шкільна хімія відрізняється від шкільної фізики, наприклад, меншою кількістю формул, які необхідно запам'ятати. З них чисто хімічних тільки вісім. Шість з цих формул пов'язані з розрахунками кількості речовини n, що виміряється в мілі:
n=m/M (1)
n=V/Vм (2)
n=N/NА; (3)
n=ѷV (4)
n=PV/RT (5)
- рівняння Менделєєва - Клапейрона (рівняння стану ідеального газу):
ne=Q/F (6)