Курсовая работа: Определение термодинамической возможности протекания химических процессов в реакции H2Cl22HCl
Вода имеет ключевое значение в создании и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды.
Физические свойства
Вода обладает рядом необычных особенностей:
- При таянии льда его плотность увеличивается (с 0,9 до 1 г/см³). Почти у всех остальных веществ при плавлении плотность уменьшается.
- При нагревании от 0 °C до 4 °C (3,98 °C — точно) вода сжимается. Благодаря этому могут жить рыбы в замерзающих водоёмах: когда температура падает ниже 4 °C, более холодная вода, как менее плотная, остаётся на поверхности и замерзает, а подо льдом сохраняется положительная температура.
- Высокая температура и удельная теплота плавления (0 °C и 333,55 кДж/кг), температура кипения (100 °C) и удельная теплота парообразования (2250 КДж/кг), по сравнению с соединениями водорода с похожим молекулярным весом.
- Высокая теплоёмкость жидкой воды.
- Высокая вязкость.
- Высокое поверхностное натяжение.
- Отрицательный электрический потенциал поверхности воды.
Химические свойства
Вода является хорошим растворителем полярных веществ. Каждая молекула растворяемого вещества окружается молекулами воды, причём положительно заряженные участки молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные — атомы водорода. Поскольку молекула воды мала по размерам, много молекул воды могут окружить каждую молекулу растворяемого вещества.
В воде практически всегда растворены те или иные соли, то есть в ней присутствуют положительные и отрицательные ионы. Благодаря этому вода проводит электричество.
Чистая (не содержащая примесей) вода — хороший изолятор.
Вода имеет показатель преломления n=1,33 в оптическом диапазоне. Однако она сильно поглощает инфракрасное излучение, и поэтому водяной пар является основным естественным парниковым газом, отвечающим более чем за 60% парникового эффекта.
Сама по себе вода относительно инертна в обычных условиях, но её сильно полярные молекулы сольватируют ионы и молекулы, образуют гидраты и кристаллогидраты.
2. Расчетная часть
2.1 Нахождение теплового эффекта реакции
Тепловым эффектом химической реакции называется теплота выделенная или поглощенная в результате протекания химической реакции и равная:
– в изобарно-изотермических условиях изменению энтальпии, если совершается только работа расширения;
– в изохорно-изотермических условиях изменению внутренней энергии, если не совершается никаких видов работ.
![]()
![]()
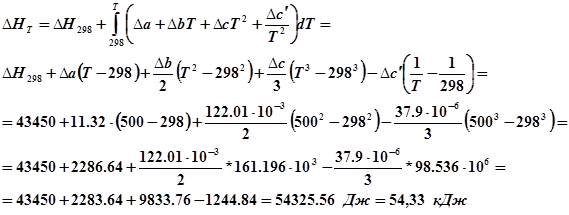
![]()
![]()
![]()
![]()
2.2 Расчет изменения энтропии химической реакции
Степень беспорядка, или неупорядоченности, в системе характеризуется физическим свойством, называемым энтропией . При переходе системы из более упорядоченного в менее упорядоченное состояние величина энтропии возрастает (![]() S > 0)
S > 0)
![]()
![]()