Курсовая работа: Определение термодинамической возможности протекания химических процессов в реакции H2Cl22HCl
![]()
![]()
Протекание реакции в прямом направлении при стандартной температуре = 298 К невозможно, реакция протекает в обратном направлении т.к. свободная энергия Гиббса ![]()
![]()
Реакция при температуре = 500 К протекает в прямом направлении т.к. свободная энергия Гиббса ![]()
2.4 Расчет 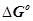 при температуре
при температуре 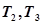 используя метод Темкина – Шварцмана
используя метод Темкина – Шварцмана
![]()
При ![]()
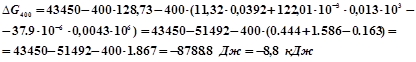
![]()
При ![]()
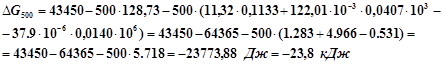
Из графика видно, что протекание реакции в прямом направлении становится возможным когда температура достигнет приблизительно 345 К.
2.5 Расчет константы равновесия
Константа равновесия характеризует глубину протекания реакции. Если ![]() >1, то содержание продуктов превышает содержание реагентов и реакция идет в прямом направлении. Если значение
>1, то содержание продуктов превышает содержание реагентов и реакция идет в прямом направлении. Если значение ![]() велико, то реагенты почти нацело превращаются в продукты реакции.
велико, то реагенты почти нацело превращаются в продукты реакции.
![]()
При ![]()
![]()
При ![]()
![]()
|
|
|
|

Заключение
По итогам проделанной работы можно сделать следующие выводы:
- При стандартной температуре = 298К, а также и при Т = 500К, реакция протекает с поглощением теплоты и носит название эндотермической реакции т.к. ![]()
При ![]() ,
, ![]()
При ![]() ,
, ![]()
- Опираясь на полученные значения энтропии
При ![]() ,
, ![]()
При ![]() ,
, ![]() видно, что:
видно, что:
![]() из чего следует, что при Т = 1000К система менее упорядочена (атомы и молекулы в веществе двигаются более хаотично), чем при Т = 298К.
из чего следует, что при Т = 1000К система менее упорядочена (атомы и молекулы в веществе двигаются более хаотично), чем при Т = 298К.
- Протекание реакции в прямом направлении при стандартной температуре = 298 К невозможно, реакция протекает в обратном направлении т.к. свободная энергия Гиббса ![]()
Реакция при температуре = 345 К и выше протекает в прямом направлении, что видно не только благодаря графику, но и подтверждается найденными значениями свободных энергий Гиббса:

4. Список литературы
1. Гаммет Л. «Основы физической органической химии» М.: Мир 1972г.