Курсовая работа: Прикладные аспекты темы Скорость химической реакции и катализ на уроках химии в средней школе
Оборудование и реактивы. Лучина, спиртовка, спички, шпатель, стеклянная палочка, штатив с пробирками, санитарная склянка; растворы пероксида водорода, гидроксида тетраамминмеди(II) [Сu(NH3 )4 ](OH)2 , Na2 SO3 , MnCl2 , CoCl2 , BaCl2 , соляной кислоты (разб.), оксид железа(III) Fe2 O3 , ацетон (диметилкетон).
Катализ – явление увеличения скорости химических реакций за счет присутствия определенных веществ (катализаторов).
Катализаторы – вещества, изменяющие скорость реакции, но сами к концу процесса остающиеся неизменными по составу и массе. Ускорение процесса – катализ. Схему катализа можно представить в таком виде:
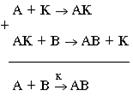
Здесь А и В – реагирующие вещества, К – катализатор, АК – промежуточное соединение, АВ – продукт реакции.
Замедление процесса – ингибирование. Существует два вида катализа – гомогенный и гетерогенный. При гомогенном катализе реагенты, продукты реакции и катализатор составляют одну фазу (газовую или жидкую), поверхность раздела отсутствует. Особый случай гомогенного катализа – автокатализ (ускорение процесса одним из продуктов реакции). Например, в кислой среде скорость реакции перманганата калия с сульфитом калия возрастает за счет образования ионов Mn2+ :
![]()
Многие реакции в растворах ускоряются ионами H3 O+ (pH < 7) и ОН- (pH > 7): гидролиз крахмала, омыление эфиров, гидролиз сахарозы и др. Ионы ![]() ,
, ![]() , CH3 COO– также сильно ускоряют реакции органических веществ.
, CH3 COO– также сильно ускоряют реакции органических веществ.

Особенность гетерогенного катализа состоит в том, что катализатор (обычно твердое вещество) находится в ином фазовом состоянии, чем реагенты и продукты. Реакция на поверхности твердого вещества идет за счет координационных связей с участием электронных пар, не участвующих в образовании связей внутри веществ. В результате внутренние связи ослабевают, и молекулы либо разрушаются, либо образуют активные радикалы.
Чем лучше адсорбируются реагенты на поверхности твердого вещества и чем слабее удерживаются продукты реакции, тем выше каталитическая активность этого вещества. Не вся поверхность гетерогенного катализатора проявляет каталитическую активность. Активные центры занимают лишь часть поверхности.
![]()
Применение каталитических методов сжигания топлива позволит в два раза поднять коэффициент его использования (сейчас 0,45) и тем самым решить вопрос обеспечения большой химии углеводородным сырьем.
| Порядок работы | Задания | Наблюдения и выводы |
| В пробирку налить 1–2 мл раствора пероксида водорода и добавить приблизительно 1 мл заранее приготовленного раствора аммиаката меди(II) | Написать уравнение реакции каталитического разложения пероксида водорода. Проверить продукты тлеющей лучинкой. Какой это вид катализа? | … |
| В две пробирки поместить оксид железа(III) объемом с горошину и прилить по 4–5 мл соляной кислоты (разб. 1:1). В одну из порций кислоты предварительно добавить 2–3 капли ацетона. Растворы перемешать стеклянной палочкой | Чем в данном процессе является диметилкетон? Какое влияние он оказывает на скорость реакции? Написать соответствующее уравнение реакции. Указать вид катализа | … |
| Проверить действие катализатора на окисление сульфита натрия кислородом. В три пробирки налить по 2–3 мл разбавленного раствора Na2 SO3 и в одну из них добавить 2–3 капли раствора MnCl2 , в другую – раствора CoCl2 . Энергично перемешать растворы и через 5–6 мин во все пробирки прилить 1–1,5 мл раствора BaCl2 |
Есть ли разница в скорости реакций? Сделать выводы о действии катализаторов на реакцию 2Na2 SO3 + O2 = 2Na2 SO4 . Составить электронный баланс процесса | Сульфит натрия широко используется как восстановитель в фотографии (для восстановления AgBr, cкрытого изображения), удаления О2 из воды на ТЭС (антикоррозионный агент), … |
1.3 Практическая работа «Влияние условий на скорость химических реакций»
Цели. Повторить понятия о скорости химических реакций и влияющих на нее факторах.
Оборудование и реактивы. Держатель для пробирок, спиртовка, спички, водяная баня, штатив с химическими пробирками, санитарная склянка; цинк (гранулы), железо (пористое восстановленное), HCl (разб., 1:2), железо (стружки), СН3 СООН (разб., 1:2), H2 SO4 (разб., 1:5), H2 SO4 (разб., 1:10) [5].
Факторы, влияющие на скорость химических реакций
| Особенности реакций | Примеры | Теоретическое обоснование |
| Природа реагирующих веществ | Металлы (K, Na) с водой реагируют с различной скоростью | Атомы металлов K и Na отдают электроны (окисляются) с разной скоростью, т. к. RK > RNa (R – радиус атома) |
| Для гомогенных процессов скорость химической реакции зависит от концентрации реагирующих веществ | Горение вещества в чистом кислороде активнее, чем в воздухе | Частота столкновений молекул реагирующих веществ зависит от их числа в единице объема, т. е. от концентрации |
| Для веществ в твердом состоянии скорость реакции прямо пропорциональна поверхности соприкосновения реагентов | Вещества железо и сера в твердом состоянии реагируют достаточно быстро лишь в измельченном виде и при перемешивании |
При измельчении и перемешивании увеличивается поверхность соприкосновения реагирующих веществ |
| При повышении температуры на каждые 10° скорость реакций увеличивается в 2–4 раза (правило Вант-Гоффа): | Со многими веществами кислород начинает реагировать с заметной скоростью уже при обычной температуре (медленное окисление), а при ее повышении скорость увеличивается | Для химической реакции взаимодействующие молекулы должны быть активны (обладать достаточно энергией). При повышении температуры доля активных молекул возрастает |
|
Скорость химической реакции зависит от присутствия катализатора (или ингибитора):
A + K
AK + В
| Разложение бертолетовой соли (KClO3 ) и пероксида водорода (H2 O2 ) ускоряется в присутствии МnО2 . В присутствии ингибиторов соляная кислота становится инертной к металлам | В присутствии катализаторов молекулы становятся реакционноспособными при более низкой температуре. Реакционная способность KClО3 проявляется при 400 °С, а в присутствии МnO2 – при 200 °C |
| В две пробирки положить по грануле цинка и прилить: в первую – 2 мл разбавленной соляной кислоты (1:2), а во вторую – 2 мл разбавленной уксусной кислоты (1:2) | Учитывая силу кислот и, следовательно, разную концентрацию ионов гидроксония (Н3 О+ ) в их растворах, объяснить различную скорость выделения свободного водорода (Н2 | ….. |
| В одну пробирку насыпать немного порошка железа, в другую – столько же железных стружек и в обе пробирки прилить по 2 мл разбавленной соляной кислоты (1:2) | Объяснить причину большей скорости выделения пузырьков газа при взаимодействии кислоты с восстановленным железом (порошком) | ..... |
| В две пробирки положить по 2 гранулы цинка: в первую – прилить 2 мл разбавленной серной кислоты (1:5), а во вторую – раствор H2 SO4 (l:10) |
Что наблюдается? Объяснить большую скорость взаимодействия в одном К-во Просмотров: 554
Бесплатно скачать Курсовая работа: Прикладные аспекты темы Скорость химической реакции и катализ на уроках химии в средней школе
|