Курсовая работа: Расчет тарельчатой ректификационной колонны для разделения бинарной углеводородной смеси бензол-толуол
рВ = РВ (1–хА ) (1.2)
По степени растворимости компонентов смеси жидкости подразделяют на взаиморастворимые в любых соотношениях, частично растворимые и практически взаимонерастворимые. В свою очередь смеси со взаиморастворимыми компонентами в любых соотношениях делятся на:
идеальные растворы, которые подчиняются закону Рауля;
нормальные растворы – жидкие смеси, частично отклоняющиеся от закона Рауля, но не образующие смесей: с постоянной температурой кипения ( азеотропов);
неидеальные растворы – жидкости со значительными отклонениями от закона Рауля, в том числе смеси с постоянной температурой кипения (азеотропы).
Смесь двух жидкостей, взаиморастворимых в любых соотношениях, представляет собой систему, состоящую из двух фаз и двух компонентов, и по правилу фаз имеет две степени свободы:
С=К–Ф+2=2–2+2=2 (1.3)
Для технических расчетов наиболее важной является диаграмма t–х,у, так как обычно процессы перегонки в промышленных аппаратах протекают при Р=const, т. е. в изобарных условиях. На этой диаграмме (см. рис. 1.2) по оси абсцисс отложены концентрации жидкой х и паровой у фаз, отвечающие различным температурам.
По закону Дальтона рА = Рy* A , и тогда
y* A = pA /P=(PA /P)xA , (1.4)
но
Р=pA +pB =PA xA +PB (1–xB )=PB +(PA –PB )xA (1.5)
тогда
xA =(P–PB )/(PA –PB ) (1.6)
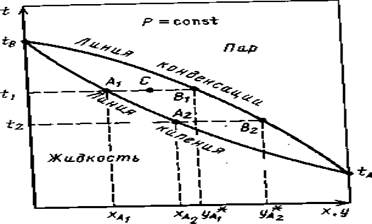
Рис . 1.2. Диаграмма t–х, у.
По уравнению (1.6) по известным РА и РB при заданной температуре t1 , t2 и т.д. находят хA , хB и т.д., а затем по уравнению (1.4) –соответствующие значения у* A1 , у* А2 и т.д. и по найденным точкам строят линии кипения жидкости (кривая tA A2 A1 tB ) и конденсации паров (кривая tA B2 Bl tB ). Уравнение (1.6) устанавливает связь между концентрациями (по жидкости) и заданными давлениями (общим Р и насыщенных паров РА и РB ). Отрезки А1 В1 , А2 В2 и т.д., соединяющие точки равновесных составов жидкой и паровой фаз, являются изотермами.
Точки, лежащие на кривой tA A2 A1 tB ,, отвечают жидкой фазе, находящейся при температуре кипения. Очевидно, что любая точка, лежащая ниже этой кривой, характеризует систему, состоящую только из жидкой фазы. Аналогично, любая точка, лежащая выше кривой tA B2 В1 tB , характеризует систему, температура которой выше температуры начала конденсации пара, т. е. пары в этой точке являются перегретыми, и система состоит только из паровой фазы. Точки, находящиеся между кривыми кипения и конденсации (например, точка С на рис. 1.2), характеризуют системы, температуры которых выше температуры кипения жидкости данного состава и ниже температуры конденсации паров этого же состава. Таким образом, эти точки отвечают равновесным парожидкостным системам.
Для идеальных бинарных систем получено уравнение (1.7), которое описывает линию равновесия:
у*А =ахА /[1+хА (а–1)], где (1.7)
а =РА /РВ – относительная летучесть компонента А (иногда а называют коэффициентом разделения).
Для смеси, состоящей из n компонентов, например, А,В,С,D, на основе законов Рауля и Дальтона имеем:
yA =(РA /Р)хA ; yB =(РB /Р)хB ; yC =(РC /Р)хC ; yD =(РD /Р)хD (1.8)
Поскольку
P=PA xA +PB xB +PC xC +PD xD +…=![]() (1.9)
(1.9)
то для любого j-го компонента
yj =Pj Xj /![]() (1.10)
(1.10)
Разделив числитель и знаменатель правой части уравнения (1.10) на величину РА :
yj =а j Xj /![]() , где (1.11)
, где (1.11)