Курсовая работа: РН-метрия
При окислительно-восстановительном титровании индикаторными электродами будут индиффирентные металлы: платина. Палладий и золото. Наиболее часто т в потенциометрии используют гладкий платиновый электрод. Переход потенциала индикаторного электрода от одной окислительно-восстановительной системы к другой сопровождается скачком потенциала и свидетельствует об окончании процесса титрования.
Кривые окислительно-восстановительного титрования могут быть построены в координатах или pM – V (титранта) или E – V (титранта), E – потенциал системы, V (титранта) – объем титранта. Кривые титрования первого типа представляют практический интерес, когда имеется индикаторный электрод, чувствительный к данному веществу. Кривые второго типа имеют более общее значение, так как любое окислительно-восстановительное титрование может быть проведено по измерению E с использованием индикаторного электрода из благородного металла.
1.3. Кислотно-основное титрование.
Кислотно-основное титрование получило также название ацидиметрии и алкалиметрии. В основе этих методов лежат протолитические реакции, в результате которых происходит связывание ионов Н3 О+ и ОН- в воду:
![]()
В кислотно-основном титровании в качестве индикаторного обычно используют стеклянный электрод, как правило, входящий в комплект серийно выпускаемых промышленностью pH-метров. Потенциометрический метод позволяет провести количественное определение компонентов в смеси кислот, если константы диссоциации различаются не менее чем на три порядка. Например, при титровании смеси, содержащей хлороводородную (HCl) и уксусную кислоты, на кривой титрования обнаруживается два скачка. Первый свидетельствует об окончании титрования HCl, второй скачок наблюдается при титровании уксусной кислоты. Также несколько скачков имеют кривые титрования многоосновных кислот, константы диссоциации которых существенно различаются (хромовая, фосфорная и др.).
Ниже мы детально рассмотрели теоретические кривые для различных случаев кислотно-основного титрования. Форма этих кривых может быть близка к форме экспериментальных кривых. Часто, однако, экспериментальные кривые смещены относительно теоретических, поскольку при построении последних, обычно, оперируют концентрациями, а не активностями. Изучение теоретических кривых показывает, что небольшая погрешность потенциометрического определения рН не имеет значения при определении конечной точки титрования.
Потенциометрическое кислотно-основное титрование особенно удобно при анализе смесей кислот или многоосновных кислот (оснований), поскольку оно часто позволяет достичь разделения конечных точек титрования. Из кривых потенциометрического титрования можно также определить приближенные значения констант диссоциации реагирующих веществ. Теоретически эту величину можно рассчитать из любой точки на кривой титрования, практически же ее легче найти из значения рН в точке полунейтрализации. Например, при титровании слабой кислоты НА в средней точке можно предположить, что
![]()
и поэтому ![]()
рКа = рН .
Важно заметить, что константы диссоциации, определенные этим способом, отличаются от констант, приводимых в таблицах, поскольку последние включают активности, в то время как первые – концентрации. Так, если мы запишем выражение для константы диссоциации в более точном виде, то получим
![]()
Примем, что ![]() , поэтому
, поэтому
![]()
Прологарифмировав обе части уравнения и изменив знак, получим, что:
![]()
Затем после приведения к р-функции и преобразования получаем:
![]()
Таким образом, истинное значение рКа будет отличаться от экспериментального на величину логарифма отношения коэффициентов активности. Обычно при титровании ионная сила равна 0,1 или больше, следовательно, отношение ![]() должно быть по крайней мере 0,75, если НА не заряжена. Для таких соединений, как
должно быть по крайней мере 0,75, если НА не заряжена. Для таких соединений, как ![]() или
или ![]() это отношение должно
это отношение должно
быть даже выше.
Из одного-единственного потенциометрического титрования можно получить и величину эквивалентной массы, и приблизительное значение константы диссоциации очищенной пробы неизвестной кислоты; часто эта информация достаточна для идентификации кислоты.
1.4. Определение конечной точки титрования.
Для определения конечной точки потенциометрического титрования можно использовать различные способы. Наиболее простой состоит в построении графика зависимости потенциала или рН от объема реагента (рис. 2.1. а). Затем визуально определяют среднюю точку участка, соответствующего вертикальному подъему кривой, и принимают ее за конечную точку. Предложены различные механические способы установления средней точки, но они ненамного улучшают точность ее нахождения.
Второй способ состоит в расчете изменения потенциала на единицу изменения объема реагента (т. е. нахождение ΔЕ/ΔV). График, построенный с использованием этого параметра как функции относительно объема, имеет острый максимум вконечной точке (рис. 2.1. б). С другой стороны, это отношение можно вычислить во время титрования и записать вместо потенциала. Как следует из данных, максимум находится между 24,3 и 24,4 мл; выбор 24,35 мл будет пригоден для большинства случаев.
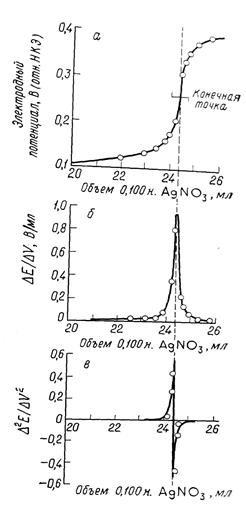
Рис. 2.1. Кривая потенциометрического титрования.
а) титрование 2,433 мэкв СІ- 0,1 н рас твором AgCI; б) кривая по первой производной; в) кривая по второй производной.
Лингейн [6] показал, что объем реагента можно зафиксировать более точно, определив точку, в которой вторая производная потенциала по объему (т. е. Δ2 Е/ΔV2 ) равна нулю. Эти вычисления несложны, если вблизи точки эквивалентности добавляют равные порции раствора реагента.
Эта функция должна обратиться в нуль в некоторой точке между двумя объемами, где происходит перемена знака. Соответствующий этой точке объем получают интерполированием. Кривая в на рис. 2.1 представляет собой график зависимости Δ2 Е/ΔV2 .
Рассмотренные выше способы основаны на предположении, что кривая титрования симметрична относительно точки эквивалентности и перегиб кривой соответствует этой точке. Это допущение совершенно справедливо при условии, что вещества, участвующие в химической реакции, взаимодействуют друг с другом в эквимолярных соотношениях и что электродный процесс полностью обратим. Если эти условия не выполняются, получается асимметричная кривая титрования. Отметим, что кривая титрования железа (II) раствором церия (IV) симметрична относительно точки эквивалентности. С другой стороны, каждый моль перманганата окисляет пять молей железа (II), что приводит к получению совершенно асимметричной кривой титрования. Обычно вблизи точки эквивалентности этих кривых изменения потенциала достаточно велики, и поэтому если за конечную точку принять среднюю точку круто восходящего участка кривой титрования, то ошибка титрования будет незначительна. Только в том случае, если требуется чрезвычайно высокая точность или, если работают с очень разбавленными растворами, следует учитывать этот источник ошибок. При необходимости можно ввести эмпирическую поправку, проведя титрование стандартного раствора. С другой стороны, когда ошибка обусловлена несимметричностью реакции, точное положение точки эквивалентности можно рассчитать теоретически [6].