Курсовая работа: Синтез ацетилферроцена
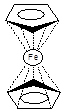
Молекула ферроцена неполярна, дипольный момент её практически равен нулю (0.05 D) и обладает диамагнетическими свойствами. ИК спектры показывают, что в соединении присутствуют С-Н связи только одного типа. Одинаковая ненасыщенность каждого атома углерода в циклопентадиенил-анионе показывает, что две таких частицы могут образовывать симметричные связи с ионом железа [1].
Данные неэмпирических расчётов приводят к распределению зарядов вида Fed + (C5 H5 )2 d - в ферроцене. В зависимости от выбранного метода расчёта величина заряда лежит в пределах d = 0.6¸1.4. Из расчётов получается, что при переходе от ферроцена к ферроцению эффективный заряд на атоме железа меняется менее чем на 0.1, в связи глубокой перестройкой молекулярных орбиталей. Становится понятным хорошо известный для ферроцена экспериментальный факт, что нейтральная молекула и ион имеют практически одну и ту же величину изомерных сдвигов в мёссбауэровских спектрах [2]. Если предположить, что изомерный сдвиг является мерой ковалентности, то ферроцен и его производные относятся к наиболее ковалентным соединениям железа.
В кристалле молекула ферроцена находится в антипризматической заторможенной конформации с точечной группой симметрии D5 d . Основные расстояния, найденные при исследовании молекулы в кристалле (в Å): Fe-C 2.000-2.075; C-C 1.40-1.41 [3]. При повышенной температуре и в газовой фазе ферроцен может существовать как в заторможенной, так и в заслонённой конформации, но данные полученные методом дифракции электронов не позволяет сделать выбор между ними. С равным успехом рассматриваются конформации с симметрией D5 h и D¥ h . Разность энергий D5 h и D5 d конформаций для ферроцена в газовой фазе оценивается ~1.1ккал/моль. Полагают, что в твёрдом состоянии величина этого барьера тоже невелика и заторможенная конформация в основном стабилизирована взаимодействиями в кристаллической решётке [4].
Долгое время по причине низкого качества кристаллов не удавалось провести достаточно хорошее рентгеноструктурное исследование солей ферроцениевого катиона. По данным исследования с тетрахлорферрат-анионом катион ферроцения в отличие от ферроцена имеет заслонённую конформацию; при этом несколько увеличивается расстояние между плоскостями колец (т.е. растут расстояния Fe-C). Расстояния (в Å) соответственно равны: Fe-C 2.08, C-C 1.40 [5].
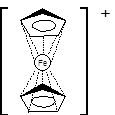
Именно строение ферроцена как высокосимметричного «сэндвича» обуславливает его поразительную стабильность и устойчивость по сравнению с другими металлоорганическими соединениями железа: он выдерживает без разрушения нагревание до температуры 470°С, устойчив к действию воздуха, горячей концентрированной соляной кислоты и 10% водного раствора щёлочи [1].
2.2 Реакции электрофильного замещения ферроцена
При реакции замещения водородов циклопентадиенильных колец и последующих превращениях заместителей не происходит разрыва связей железа с атомами углерода. Нет другого металлоорганического соединения, для которого были бы осуществлены столь многочисленные превращения без разрыва или изменения природы связи углерода с металлом. Ферроценильная группа ведёт себя как устойчивый радикал, переходящий без изменения из соединения в соединение, т.е. так, как представляли себе на заре развития органической химии создатели «теории радикалов».
В молекуле ферроцена имеется два типа нуклеофильных центров – атомы углерода и атом железа. В настоящее время до конца не выяснено, какой из этих нуклеофильных центров является местом первоначальной атаки. Высказано предположение, что при электрофильном замещении в металлоценах существенную роль играет атом металла. Эта идея легла в основу представлений о механизме электрофильного замещения в ферроцене, согласно которым первая стадия замещения представляет собой быстрое обратимое присоединение электрофила к атому железа. На второй, медленной стадии происходит перемещение электрофила в кольцо, приводящее к эндоциклическому s–комплексу, которому авторы приписывают структуру, аналогичную структуре s–комплексов бензольного ряда. На третьей стадии быстро отщепляется протон и образуется замещённый ферроцен [6].
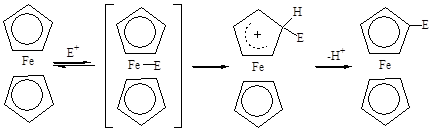
Существенной особенностью предложенного механизма является подход электрофила к пятичленному кольцу со стороны атома железа. Исследование внутримолекулярного ацилирования эпимерной пары кислот, в которых из-за их пространственного строения затруднены в первом случае эндо-, а во втором – экзо-циклическая электрофильная атака, показало, что обе кислоты под действием ангидрида трифторуксусной кислоты циклизуются в гомоциклический кетон, причём скорость циклизации экзо-кислоты несколько больше, чем скорость циклизации эндо-кислоты [7].
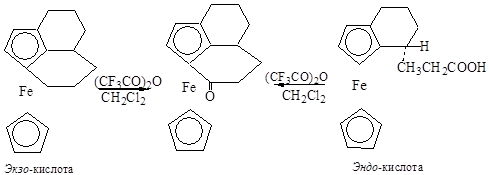
В статьях последних лет предполагается, что жёсткие электрофилы атакуют ферроцен со стороны одного из циклопентадиенальных колец (экзо-атака), а мягкие электрофилы должны сначала образовывать прекомплексы с атомом металла, а затем атаковать пятичленные кольца (эндо-атака) [8].
Водороды С5 Н5 -колец в мягких условиях замещаются на различные группы. Осуществлено ацилироване, формилирование, алкилирование, сульфирование, диалкил амино метилирование, металлирование и аррилирование ферроцена. Эти реакции идут легче, чем с бензолом. При электрофильном замещении заменяется сначала один водородный атом, а потом второй в другом С5 Н5 -кольце.
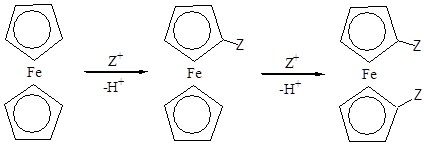
Для перечисленных выше электрофильных реакций (кроме ациллирования), а так же для ариллирования найдены условия при которых с препаративными выходами получаются моно- или гетнроаннулярные дизамещённые ферроцены. Гомоаннулярные производные Z2 C5 H3 FeС5 Н5 и тризамещённые Z2 C5 H3 FeС5 Н4 Z образуются в незначительном количестве.
Разнообразные производные ферроцена получены как путём прямой замены водорода, так и при последующих превращениях заместителей. Эти превращения в основном аналогичны реакциям соединений бензольного ряда.
2.3 Сравнение электрофильности ферроценов и бензола.
Несмеяновым и его сотрудниками было показано, что по общему характеру реакционной способности ферроцен является ярким примером небензоидной ароматической системы [9]. Для того, чтобы охарактеризовать относительную электрофильность этого ряда, они воспользовались простейшей реакцией электрофильного замещения – реакцией изотопного обмена водорода, а также сопоставили константы скорости, полученные для ферроцена и его производных, с константами скорости изотопного обмена водорода производных бензола. Наиболее удобным донором дейтерия оказалась трифтордейтероуксусная кислота, обладающая высокой функцией кислотности (Н0 = -3.03) и являющаяся хорошим растворителем для многих органических веществ. Была изучена кинетика водородного обмена ферроцена, ацетилферроцена, диацетилферроцена и толуола трифтордейтероуксусной кислоте при температуре 25°С, используя в качестве растворителя бензол. В расчёт принимались атомы водорода только углеводородных колец.
Если принять константу скорости водородного обмена толуола за единицу, то исследуемые соединения по их убывающей способности к электрофильному замещению можно расположить в следующем порядке:
Ферроцен > ацетилферроцен > 1,1’-диацетилферроцен > толуол
5333 5.0 2.6 1
Таким образом, способность к реакциям электрофильного замещения у ферроцена оказалась более чем на три порядка выше, чем у толуола. Введение ацетильной группы в ядро ферроцена понижает скорость водородного обмена циклопенпадиенальных колец в 1000 раз по сравнению с незамещённым ферроценом. Бензол в этих условиях в реакцию водородного замещения не вступает.
Поэтому замещение водорода в ферроцене при действии электрофильных реагентов происходит в более мягких условиях, нежели в бензоле.
Влияние заместителей в циклопентадиенальном кольце на замещение других водородов ферроценильной группы аналогично влиянию в бензольном ряду: электроноакцепторные заместители затрудняют реакции электрофильного замещения, а электронодонорные заместители облегчают эти реакции. Однако граница между электронодонорными и электроноакецепторными заместителями иная, чем в бензольном ряду. Это обусловлено большей, чем у бензола, нуклеофильностью ферроцена, а также различиями таутомерного и индуктивного эффектов заместителей в ферроценовом и бензольном ядрах. Правила ориентации при электрофильном замещении менее чётки, чем в бензольном ряду.
2.4 Ацилирование ферроцена
Ацилирование циклопентадиенилжелеза и его производных осуществлено многими реагентами. Первый ацил был синтезирован при взаимодействии ферроцена с ацетилхлоридом в присутствии хлористого алюминия [10]. Эта реакция дала толчок для изучения ароматических свойств данной системы, а также дала ферроцену его название.
При ацилировании ферроцена получают моно- и ди-ацилферроцены в зависимости от соотношения реагентов, характера взятого катализатора и его количества.
Моноацилферроцены получаются при ацилировании ферроцена галогенангидридами или ангидридами карбоновых кислот в присутствии хлористого алюминия. Однако наряду с монокетоном всегда образуется дикетон.
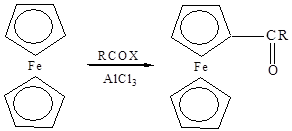
Если хлористый алюминий взят в избытке, то образуется только дикетон даже при эквимольных количествах ферроцена и галогенангидрида. Также при избытке хлорида алюминия (III) ферроцен может протонироваться выделяющимся хлористым водородом и осаждается в виде комплекса, который не ацилируется [11]:
C10 H10 Fe + AlCl3 + HCl ![]() (C10 H11 Fe)+ ( AlCl4 )-
(C10 H11 Fe)+ ( AlCl4 )-
Моноацилирование ферроцена лучше проводить в присутствии более мягких, чем хлористый алюминий, катализаторов (хлорное олово, фосфорная кислота).
Моноацетилферроцен получается при действии на ферроцен силикоангидрида уксусной кислоты и четырёххлористого олова:
![]()
4(C5 H5 )2 Fe + Si(OCOMe)4 ![]() 4C5 H5 FeC5 H4 COMe + Si(OH)4
4C5 H5 FeC5 H4 COMe + Si(OH)4