Курсовая работа: Сірка та її сполуки
6)
3S0 + 6KOH =>K2S+4 O3 + 2K2 S-2 + 3H2 O
7) сірка розчиняється в концентрованому розчині сульфіту натрію:
S0 + Na2 S+4 O3 =>Na2 S2 O3 тиосульфат натрію
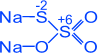
Застосування
Вулканізація каучуку, отримання ебоніту, виробництво сірників, пороху, в боротьбі з шкідниками сільського господарства, для медичних цілей (сірчані мазі для лікування шкірних захворювань), для отримання сірчаної кислоти і так далі.
5. СПОЛУКИ
Сполуки з киснем
Всі кисневі з'єднання сірки є екзотермічними.
Оксиди: відомі як вищі, так і нижчі оксиди сірки. До останніх
відносяться такі нестійкі оксиди, як S2 O3 і S2 O. Наприклад, S2 O утворюється в зоні електричного розряду, що проходить в атмосфері SO2 , і миттево розкладається:
2S2 O=>3S + SO2
аналогічно диспропорціонує і S2 O3
2S2 O3 => S + 3SO2 .
З вищих оксидів сірки найбільш вивчені SO2 - оксид сірки IV (сірчистий ангідрид) і SO3 -оксид сірки VI (ангідрид сірчаної кислоти).
Діоксидом сірки є безбарвний газ з різким запахом, Тпл = -75 С, Ткип = -10 С. Він дуже термічно стійкий (розпадається на S і O2 при 2800 С). Діоксид сірки розчинимо у воді причому розчинність його під час переходу температури від 0 до кімнатної знижується. При розчиненні відбувається утворення гідрата SO2 · хН2 О, що нестехіометричного по складу, володіє властивостями слабкої кислоти:
SO2 · хН2 О + Н2 О => Н3 О+ + НSО3
Ка= 1,54·10-2 (при 25є)
Абсолютно сухий діоксид сірки в звичайних умовах не взаємодіє з галогенами, H2 S, H2 , O2 і З. Реакція :
2SO2 + O2 => 2SO3
протікає тільки при високих температурах, у присутності каталізатора. Діоксид сірки у водному розчині взаємодіє HNO2 і N2 O3 :
2SO2 + N2 O3 + Н2 O => H2 SO4 + 2NO
2HNO2 + SO2 · хН2 О =>H2 SO4 + 2NO + xH2 O
У більшості реакцій він проявляє відновні властивості:
2HNO3 + SO2 =>H2 SO4 + 2NO2
NO2 + SO2 =>SO3 + NO; Н2 O2 + SO2 =>H2 SO4
Окислювальні властивості діоксиду сірки виявляються при взаємодії його з сірководнем і оксидом вуглецю (II):
2Н2 S + SO2 => 3S + 2Н2 О;
2СО + SO2 =>S+ 2CO2
Сульфіди
Отримання
1) Багато сульфідів отримують нагріванням металу з сіркою:
Hg + S =>HgS
2) Розчинні сульфіди отримують дією сірководня на лузі:
H2 S + 2KOH =>K2 S + 2H2 O
3) Нерозчинні сульфіди отримують обмінними реакціями:
CdCl2 + Na2 S =>2NaCl + CdS
Pb (NO3 )2 + Na2 S => 2NaNO3 + PbS
ZnSO4 + Na2 S =>Na2 SO4 + ZnS
MnSO4 + Na2 S =>Na2 SO4 + MnS
2SbCl3 + 3Na2 S =>6NaCl + Sb2 S3
SnCl2 + Na2 S => 2NaCl + SnS
Хімічні властивості
1) Розчинні сульфіди сильно гідролізовані, унаслідок чого їх водні розчини мають лужну реакцію:
K2 S + H2 O =>KHS + KOH
S2- + H2 O =>HS- + OH-
2) Сульфіди металів, що стоять у ряді напруги лівіше заліза (включно), розчиннів сильних кислотах:
ZnS + H2 SO4 =>ZnSO4 + H2 S
Нерозчинні сульфіди можна перевести в розчинний стан дією концентрованої HNO3 :
FeS2 + 8HNO3 Е Fe(NO3 )3 + 2H2 SO4 + 5NO + 2H2 O
3) Водорозчинні сульфіди розчиняють сірку з утворенням полісульфідів:
Na2 S + S =>Na2 S
Полісульфіди при окисленні перетворюються на тиосульфати, наприклад:
2Na2 S2 + 3O2 => 2Na2 S2 O3
Кислоти
Сірчана кислота є маслянистою рідиною з Тпл = 10 С і Ткип = 280 С. Її молекули представлені тетраедрами, зв'язаними між собою атомом кисню:
HO O
S
HO O
Сірчана кислота у водних розчинах є сильною двоосновною. Концентрована сірчана кислота є сильним окислювачем. Залежно від виду відновника реакції можуть закінчуватися виділенням SO2 , H2 S і елементарної сірки.
H2 SO4 (конц.) + H2 S => S + SO2 + H2 O
H2 SO4 (конц.) + Cu => SO2 +CuSO4 + H2 O
H2 SO4 (конц.) + Mg => MgSO4 + H2 S + H2 O