Курсовая работа: Состав атмосферы и его формирование в процессе эволюции биосферы
За всю историю существования нашей планеты в результате бактериального и растительного фотосинтеза выделилось 1,8-2,3*![]() г
г ![]() . Эта величина получена на основе данных о количестве органического углерода, захороненного в осадках. Для окисления горных пород, находящихся на Земле, потребовалось бы почти на порядок большее количество кислорода. Следовательно, фотосинтезирующие организмы могли лишь частично сформировать кислородную атмосферу Земли[3].
. Эта величина получена на основе данных о количестве органического углерода, захороненного в осадках. Для окисления горных пород, находящихся на Земле, потребовалось бы почти на порядок большее количество кислорода. Следовательно, фотосинтезирующие организмы могли лишь частично сформировать кислородную атмосферу Земли[3].
На основе изучения изотопного состава ![]() воздуха показано, что кислород атмосферы состоит на 2/3 из кислорода геологического происхождения и на 1/3 из кислорода, генерированного фотосинтезирующими организмами. Первичный кислород образовался в результате дегазации базальтовой магмы ( поступление
воздуха показано, что кислород атмосферы состоит на 2/3 из кислорода геологического происхождения и на 1/3 из кислорода, генерированного фотосинтезирующими организмами. Первичный кислород образовался в результате дегазации базальтовой магмы ( поступление ![]() из земных недр продолжается и в настоящее время). Коллектором этого газа служат воды океана. Биогенный кислород появился позже. В итоге современная атмосфера формируется за счет как абиогенного, так и биогенного кислорода.
из земных недр продолжается и в настоящее время). Коллектором этого газа служат воды океана. Биогенный кислород появился позже. В итоге современная атмосфера формируется за счет как абиогенного, так и биогенного кислорода.
Деятельность человека в основном направлена на уменьшение количества кислорода в атмосфере. В связывании свободного кислорода воздуха заключается сущность сжигания любого органического топлива. Ежегодно человеком в процессе сжигания из атмосферы извлекается около 9*![]() г кислорода, что составляет почти 2% его количества, вырабатываемого за этот период растениями биосферы. Отрицательное влияние деятельности человека на развитие лесов также вносит ощутимый «вклад» в уменьшение поступления кислорода в атмосферу вследствие фотосинтеза. Хотя эта отрицательная роль человека в некоторой степени компенсируется орошением и сельскохозяйственным озеленением засушливых земель, однако масштабы этих процессов до настоящего времени несоизмеримы[2].
г кислорода, что составляет почти 2% его количества, вырабатываемого за этот период растениями биосферы. Отрицательное влияние деятельности человека на развитие лесов также вносит ощутимый «вклад» в уменьшение поступления кислорода в атмосферу вследствие фотосинтеза. Хотя эта отрицательная роль человека в некоторой степени компенсируется орошением и сельскохозяйственным озеленением засушливых земель, однако масштабы этих процессов до настоящего времени несоизмеримы[2].
5. Второстепенные компоненты атмосферы
5.1 Аргон
Это наиболее распространенный инертный газ атмосферы, который почти полностью имеет радиогенное происхождение и образуется в результате распада радиоактивного изотопа калия-40 по схеме
 +е→
+е→![]() .
.
Период полураспада 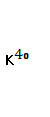 , который составляет 0,0119% природного калия, равен 1,3 млрд. лет. Таким образом, поступление аргона в воздушную оболочку Земли из литосферы происходит постоянно. Изотопный состав следующий:
, который составляет 0,0119% природного калия, равен 1,3 млрд. лет. Таким образом, поступление аргона в воздушную оболочку Земли из литосферы происходит постоянно. Изотопный состав следующий: ![]() 96,6%;
96,6%; ![]() 0,063%;
0,063%; ![]() 0,337%[2].
0,337%[2].
5.2 Углекислый газ
В атмосфере содержится 58*![]() моль углерода в составе углекислого газа. В отличие от кислорода, основная масса которого заключена в атмосфере, лишь около 2% свободного
моль углерода в составе углекислого газа. В отличие от кислорода, основная масса которого заключена в атмосфере, лишь около 2% свободного ![]() находится в газообразном состоянии в воздухе. Оставшиеся 98% углекислого газа ( 2943*
находится в газообразном состоянии в воздухе. Оставшиеся 98% углекислого газа ( 2943*![]() моль углерода) растворены в гидросфере и, таким образом, заключены в Мировом океане[3].
моль углерода) растворены в гидросфере и, таким образом, заключены в Мировом океане[3].
Зеленые растения в процессе фотосинтеза накапливают углерод из воздуха, превращая углекислый газ в сложные углеводороды, имеющие общую формулу –СООН-. Биологический цикл углерода в окружающей среде может быть изображен следующей схемой:
![]() →-СООН-→
→-СООН-→![]()
газ тв. вещ-во газ
Органическое вещество, являющееся аккумулятором солнечной энергии, в определенных условиях после гибели растений и живых организмов может быть преобразовано в ископаемые, обогащенные углеродом, твердые и жидкие органические продукты, концентрирующие энергию, аккумулированную живым веществом. Эти продукты – каменный уголь и нефть – являются в настоящее время главной энергетической базой человеческого общества и уже в течение ряда столетий повсеместно используются в качестве горючих полезных ископаемых. Образование последних происходило в результате захоронения органических остатков в осадочных породах, что преграждало доступ к ним свободного кислорода. В противном случае в процессе разложения весь углерод органического веществ был окислен до ![]() .Особенно благоприятные условия для захоронения отмерших растительных остатков в девонском и каменноугольном периодах палеозойской эры. Захоронение органических остатков в течение геологического времени сохранило в атмосфере значительное количество кислорода. На важную роль геохимическую роль захоронения углерода для формирования кислородной атмосферы земного шара указывал В. И. Вернадский. Однако в последнее столетие человек с поразительной быстротой использует горючие ископаемые, которые накапливались в земной коре в течение сотен миллионов лет. Ежегодно в атмосферу выводится порядка 0,42*
.Особенно благоприятные условия для захоронения отмерших растительных остатков в девонском и каменноугольном периодах палеозойской эры. Захоронение органических остатков в течение геологического времени сохранило в атмосфере значительное количество кислорода. На важную роль геохимическую роль захоронения углерода для формирования кислородной атмосферы земного шара указывал В. И. Вернадский. Однако в последнее столетие человек с поразительной быстротой использует горючие ископаемые, которые накапливались в земной коре в течение сотен миллионов лет. Ежегодно в атмосферу выводится порядка 0,42*![]() моль углерода. Столь значительные поступления техногенного углекислого газа в течение последнего столетия существенно увеличили его содержание в атмосфере. Эффект воздействия растущей концентрации
моль углерода. Столь значительные поступления техногенного углекислого газа в течение последнего столетия существенно увеличили его содержание в атмосфере. Эффект воздействия растущей концентрации ![]() в атмосфере на окружающую среду в течение длительного времени обсуждается специалистами. Главную заботу при этом вызывает способность углекислого газа к абсорбции длинноволнового излучения, что может привести к так называемому парниковому эффекту, следствием которого должно быть постепенное потепление климата. При существующих масштабах накопления
в атмосфере на окружающую среду в течение длительного времени обсуждается специалистами. Главную заботу при этом вызывает способность углекислого газа к абсорбции длинноволнового излучения, что может привести к так называемому парниковому эффекту, следствием которого должно быть постепенное потепление климата. При существующих масштабах накопления ![]() расчетный уровень потепления составляет 2ºС[3].
расчетный уровень потепления составляет 2ºС[3].
При переходе человечества на использование иных видов энергии ( ядерной, солнечной, геотермальной и т. д. приток ![]() в атмосферу резко сократится. При сохранении существующих темпов роста потребления ископаемого топлива запасов каменного угля на Земле хватит на 150 лет, а нефти и газа соответственно на 50 и 49 лет. Таким образом, после 2020 г следует ожидать резкого уменьшения поступления техногенного
в атмосферу резко сократится. При сохранении существующих темпов роста потребления ископаемого топлива запасов каменного угля на Земле хватит на 150 лет, а нефти и газа соответственно на 50 и 49 лет. Таким образом, после 2020 г следует ожидать резкого уменьшения поступления техногенного ![]() в атмосферу. В последующие несколько тысяч лет в результате регулирующего воздействия океана содержание углекислого газа в атмосфере будет понижено до уровня, соответствующего природному равновесию[1].
в атмосферу. В последующие несколько тысяч лет в результате регулирующего воздействия океана содержание углекислого газа в атмосфере будет понижено до уровня, соответствующего природному равновесию[1].
6.Микрокомпоненты атмосферы
6.1 Редкие инертные газы ( неон, криптон, гелий, ксенон, радон)
Инертные газы в условиях атмосферы Земли и в биосфере не вступают в какие-либо химические реакции, полностью оправдывая свое название. Наиболее распространенный из них – аргон – по массе составляет более 1% атмосферы, а наименее распространенный – радон – всего 6*![]() %[5].
%[5].
Происхождение основной массы неона ![]() в атмосфере остается не вполне ясным.
в атмосфере остается не вполне ясным. ![]() является самым распространенным, стабильным изотопом атмосферного неона ( 90,92% ). По всей вероятности, он освобождается и поступает в атмосферу в процессе разрушения магматических горных пород, а так же из вулканических источников. Два других стабильных изотопа
является самым распространенным, стабильным изотопом атмосферного неона ( 90,92% ). По всей вероятности, он освобождается и поступает в атмосферу в процессе разрушения магматических горных пород, а так же из вулканических источников. Два других стабильных изотопа ![]() (0,257%) и
(0,257%) и ![]() (8,82%), судя по имеющимся данным, имеют радиогенное происхождение. Считается, что основная масса неона в связи с легкостью этого газа ( неон легче в 1,5 раза воздуха) была потеряна атмосферой на ранних стадиях геологической эволюции Земли[6].
(8,82%), судя по имеющимся данным, имеют радиогенное происхождение. Считается, что основная масса неона в связи с легкостью этого газа ( неон легче в 1,5 раза воздуха) была потеряна атмосферой на ранних стадиях геологической эволюции Земли[6].
Криптон ксенон – весьма редкие инертные газы, находящиеся в атмосфере в состоянии крайнего рассеяния. Они поступают в атмосферу с вулканическими эманациями и газами термальных источников[3].
Гелий – наиболее легкий из инертных газов, являющийся конечным продуктом распада урана и тория. Каждый грамм урана, рассеянного в горных породах, в течение года выделяет 1,16*![]() мл гелия, каждый грамм тория соответственно 2,43*
мл гелия, каждый грамм тория соответственно 2,43*![]() мл. В отличие от прочих инертных газов гелий, несмотря на крайне низкое его содержание в атмосфере, в ряде случаев накапливается в литосфере в значительных количествах, играя заметную роль в составе рудничных газов, а также в природных газах, богатых азотом. Обогащены гелием и газы некоторых термальных источников. Количество гелия, поступившего в атмосферу в процессе геологической эволюции литосферы, должно быть значительно больше его количества, присутствующего в настоящее время в тропосфере и стратосфере. В этой связи был сделан вывод о непрерывном уходе (диссипации) гелия из атмосферы Земли в космическое пространство. В космосе и атмосфере Солнца гелий в отличие от атмосферы Земли является вслед за водородом наиболее распространенным элементом[2].
мл. В отличие от прочих инертных газов гелий, несмотря на крайне низкое его содержание в атмосфере, в ряде случаев накапливается в литосфере в значительных количествах, играя заметную роль в составе рудничных газов, а также в природных газах, богатых азотом. Обогащены гелием и газы некоторых термальных источников. Количество гелия, поступившего в атмосферу в процессе геологической эволюции литосферы, должно быть значительно больше его количества, присутствующего в настоящее время в тропосфере и стратосфере. В этой связи был сделан вывод о непрерывном уходе (диссипации) гелия из атмосферы Земли в космическое пространство. В космосе и атмосфере Солнца гелий в отличие от атмосферы Земли является вслед за водородом наиболее распространенным элементом[2].
Радон – радиоактивный инертный газ – вследствие своей недолговечности не является постоянным компонентом атмосферы и поэтому рассматривается в группе ксенокомпонентов атмосферы[2].
6.2 Водород
Содержание свободного водорода в атмосфере ничтожно. Его источником являются вулканические процессы, многие магматические и осадочные горные породы, а так же биогенные процессы, идущие при участии водородообразующих бактерий[2].
В атмосфере водород неустойчив и легко соединяется с кислородом. Таким образом, его относительно постоянное на данный геологический период содержание в атмосфере может рассматриваться как динамическое равновесие, определяемое физико-химическими и гравитационными факторами. Большинство исследователей признает возможность ухода (диссипации) атомов водорода за пределы атмосферы в космическое пространство.
Из числа изотопов водорода в атмосфере присутствуют тритий ![]() - Т, количество которого измеряется значением 4*
- Т, количество которого измеряется значением 4*![]() ат. %. Тритий образуется естественным путем в верхних слоях атмосферы в результате бомбардировки атомов азота нейтронами космических лучей по схеме
ат. %. Тритий образуется естественным путем в верхних слоях атмосферы в результате бомбардировки атомов азота нейтронами космических лучей по схеме ![]() +n→
+n→![]() +T. Образование трития имеет место также при ядерных взрывах в атмосфере. Однако в связи с запрещением испытаний атомного оружия в атмосфере количество техногенного трития, имеющего сравнительно короткий период полураспада ( 12,262 лет ), в атмосфере значительно уменьшилось[2].
+T. Образование трития имеет место также при ядерных взрывах в атмосфере. Однако в связи с запрещением испытаний атомного оружия в атмосфере количество техногенного трития, имеющего сравнительно короткий период полураспада ( 12,262 лет ), в атмосфере значительно уменьшилось[2].
7.Ксенокомпоненты атмосферы, включая антропогенные загрязнители.
7.1 Метан и другие газообразные углероды
Незначительное количество метана ![]() постоянно отмечается в земной атмосфере. Он образуется в процессе разложения органического вещества при условии недостатка кислорода почвах, особенно в болотах ( болотный газ ) и захороненных осадках. Процесс преобразования захороненного органического вещества в каменные угли и жидкие углеводороды сопровождается отделением значительного количества метана. Так, метан составляет около 90% массы газа в его месторождениях. Поступление метана из осадочных толщ, газовых, нефтяных и угольных месторождений, а также из разлагающихся в восстановительных условиях органических остатков является естественным источником этого наиболее простого углеводорода в атмосфере. Некоторая часть метана в биосфере окисляется особыми видами бактерий до углекислого газа и воды по схеме:
постоянно отмечается в земной атмосфере. Он образуется в процессе разложения органического вещества при условии недостатка кислорода почвах, особенно в болотах ( болотный газ ) и захороненных осадках. Процесс преобразования захороненного органического вещества в каменные угли и жидкие углеводороды сопровождается отделением значительного количества метана. Так, метан составляет около 90% массы газа в его месторождениях. Поступление метана из осадочных толщ, газовых, нефтяных и угольных месторождений, а также из разлагающихся в восстановительных условиях органических остатков является естественным источником этого наиболее простого углеводорода в атмосфере. Некоторая часть метана в биосфере окисляется особыми видами бактерий до углекислого газа и воды по схеме:
![]() + 2
+ 2![]() →
→![]() + 2
+ 2![]() .
.
Содержание более тяжелых, чем метан углеводородов в тропосфере ничтожно и практически не поддается определению. Тяжелыми углеводородами обогащены газы нефтяных месторождений ( 17% ), в то время как в месторождениях газа среднее содержание тяжелых углеводородов в среднем составляет около 3%[6].
7.2 Окись углерода
В отличие от углекислого газа, являющегося вместе с кислородом основой жизни на Земле. Окись углерода СО не характерна для природных процессов в окружающей среде. Обладая токсическими свойствами, окись углерода отрицательно действует на живые организмы. Концентрации СО, превышающие 10 мг на 1 м³ воздуха, опасны для здоровья человека[2].
Появление окиси углерода в тропосфере является полностью следствием деятельности человека, если исключить образование некоторого количества ее во время лесных пожаров. В этой связи содержание окиси углерода в воздухе может служить объективным показателем степени его загрязненности[2].
Исходя из годового потребления жидкого топлива различными странами, поступление техногенной окиси углерода в тропосферу может быть оценено в 230 млн. т/год[2].
Содержание окиси углерода в воздухе уже в настоящее время в ряде крупных городов (Нью-Йорк, Лос-Анджелес, Токио и др.) представляет угрозу для здоровья людей, особенно в жаркие и безветренные периоды года[2].
7.3 Сероводород
Поступление незначительных количеств природного сероводорода 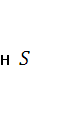 в атмосферу в основном обусловлено процессами бактериального разложения органического вещества в условиях резкого недостатка кислорода. Некоторое количество
в атмосферу в основном обусловлено процессами бактериального разложения органического вещества в условиях резкого недостатка кислорода. Некоторое количество 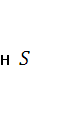 выбрасывается в атмосферу вместе с другими газами в результате вулканических процессов, а также поступает на поверхность с термальными источниками[1].
выбрасывается в атмосферу вместе с другими газами в результате вулканических процессов, а также поступает на поверхность с термальными источниками[1].