Курсовая работа: Технология нуклеофильного замещения функциональных групп в органических соединениях
Допустимые выходы первичных аминов дают лишь α-галогенкарбоновые кислоты при действии большого избытка аммиака. Таким образом получают:
 (45)
(45)
Реакцию ведут, нагревая при 40—50 °С соответствуюшую галогензамещенную кислоту с концентрированным водным раствором аммиака и карбоната аммония. Выходы α-аминокислот — 60—70%.
В неактивированных галогенпроизводных ароматического ряда галоген может быть замещен на аминогруцпу действием раствора аммиака при высокой температуре и давлении в присутствии катализатора (Сu2 O, СuSO4 , и т.д.). Другой способ состоит в действии амид-иона в жидком аммиаке. Реакция в этом случае идёт через образование дегидробензола.[2]
Условия проведения реакции в активированных соединениях зависят от степени активации галогена:
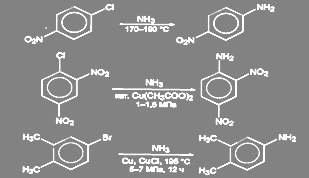 (46)
(46)
3-хлор-6-(п-аминбензолсульфаниламидо)-пиридазин получают из 3,6-дихлорпиридазина. Реакцию ведут в среде циклогексанола с добавкой пиридина и значительного количества поташа (2 моля на 1 моль) при температуре 135 – 160 ºС: T5r
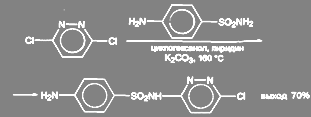 (47)
(47)
Получение 2-метил-4-(α-метил-δ-диэтиламинобутиламино)-6-метоксихинолина в производстве трихомонацида ведут в более жёстких условиях, в этом случае требуется двойной избыток диэтиламино-4-аминопентана и температура 185 – 190 ºС:
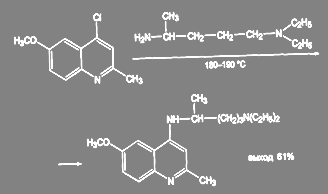 (48)
(48)
При получении антидеприсанта азафена аминирование ведут дигидрохлоридом N-метилпиперазина:
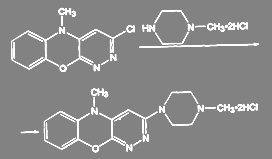 (49)
(49)
Получение амидов из хлорангедридов кислот идёт в мягких условиях. Так, получение диакарба проводят при температуре 3-4 ºС действием охлаждённого раствора аммиака на соответствующий сульфохлорид:
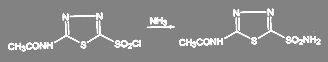 (50)
(50)
Аналогичные реакции имеют место при получении метилуретана:
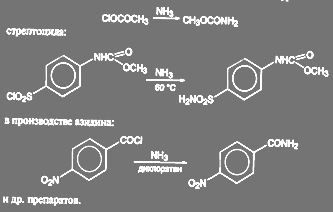 (51)
(51)
1.5 Замена атома галогена на - СN и - SO3 Na
Замена галогена на СN-группу является относительно простым способом удлинения углеродной цепи. Этот способ, однако, неприменим для пространственно затрудненных субстратов. Первичные галогениды, а также бензил- и аллилгалогениды дают хорошие выходы нитрилов. В случае вторичных алкилгалогенидов выходы средние. С третичными галогенидами реакция не идет, так как в этих условиях проходит реакция не замещения, а элиминирования, Для проведения синтеза пригодны многие растворители, но наилучшие результаты достигаются в диметилсульфоксиде (ДМСО).[6]
Реакционная способность алкилгалогенидов увеличивается в ряду CI< Вr <I, что позволяет проводить реакцию избирательно:
![]() (52)
(52)
Поскольку цианид-ион является амбидентнsм ионом, реакция может идти по двум направлениям — с образованием нитрилов и изонитрилов:
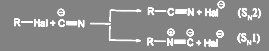 (53)
(53)
В случае первичных алифатических галогенидов и бензилгалогенидов в спиртах и водно-спиртовых смесях нежелательная примесь изонитрилов не образуется или образуется в очень малых количествах (легко обнаруживается по крайне неприятному запаху).
В случае ароматических галогензамещенных реакцию следует вести в апротонных растворителях. Галогенбезолы могут также превращаться в соответствующие фенилцианиды при нагревании до 200 °С с цианидом меди (1) в растворе пиридина:
![]() (54)
(54)
Реакционноспособные алкилгалогениды переводят в нитрилы кипячением галогенида и цианида натрия в сухом ацетоне с добавлением небольшого количества (0,05 моля на 1 моль субстрата) иодида натрия. Для инетных галогенидов в качестве растворителя используют 70—90% спирт или триэтиленгликоль. Правильный выбор растворителя во многом определяет успех реакции. Так, например, алифатические нитрилы можно получать с высоким выходом в ДМСО или ДМФА. Наибольшие примеси изонитрила можно гидролизовать в кислой среде и таким образом отделить от основного продукта, так как нитрилы гидролизуются в значительно более жестких условиях.[17]
Нитрилы являются важными промежуточными продуктами в синтезе многих химико-фармацевтических препаратов, так как легко превращаются в амиды карбоновых кислот, кар