Курсовая работа: Выделение мембранных белков
Используя мембрану эритроцитов как модель, исследователи выявили два типа мембранных белков. Белки первого типа, называемые периферическими белками, связаны с мембраной в основном ионными взаимодействиями. Если обработать препарат мембран буферным раствором с высокой концентрацией солей, белки этого типа освобождаются от мембраны и переходят в буфер. Примеры периферических белков – фибронектин(локализован на наружной поверхности большинства клеток, исключая циркулирующие клетки крови) и спектрин (находится на внутренней поверхности большинства клеточных мембран, особенно в эритроцитах).
Мембранные белки второго типа называются интегральными белками. Эти протеины или погружены в толщу липидного бислоя, или пронизывают мембрану насквозь (трансмембранные белки). К интегральным относят также белки, ковалентно связанные с молекулами мембраны. Все интегральные белки можно выделить. только разрушив мембрану. Для выделения и изучения интегральных белков их очищают от липидов, либо экстрагируя их органическими растворителями (такими как ацетон или спирты), либо растворяют липиды с помощью детергентов. Большинство мембранных белков являются интегральными.
На заре развития мембранологии полагали, что мембранные белки по своей структуре довольно гомогенны и уложены в виде β-слоев по поверхности бислоя. Сейчас принято считать, что большинство мембранных белков в своей мембранной части состоят из одной или нескольких ассоциированных α-спиралей, многие мембранные белки олигомеризуются. Причем “правильная” олигомеризация α-спиралей является необходимым условием выполнения белком своей функции. Наиболее изученным из олигомеризующихся мембранных белков является белок эритроцитов человека - гликофорин А, который образует устойчивый димер не только в природных системах, но и в искусственных липидных средах, таких как мицеллы додецилфосфохолина (DPC). Интегральные мембранные белки могут оказаться гораздо сложнее, чем мы сейчас представляем. Классификация растворимых белков по типам структур была проведена только после того, как установили с высоким разрешением структуру более 100 различных белков. Что касается трансмембранных белков, то это удалось сделать только в одном случае - для белка фотосинтетического реакционного центра бактерий. Вместе с электронно-микроскопическими данными низкого разрешения о структуре бактериородопсина это единственный источник, на котором может основываться построение моделей для большинства других трансмембранных белков. Молекулярная масса мембранных белков обычно варьирует в пределах от 10 тыс. до 240 тыс.
Еще один важный момент - способы прикрепления белков к мембране:
1. Связывание с белками, погруженными в бислой. В качестве примеров можно привести F1-часть Н + - АТРазы, которая связывается с Fo-частью, погруженной в мембрану; можно упомянуть также некоторые белки цитоскелета.
2. Связывание с поверхностью бислоя. Это взаимодействие имеет в первую очередь электростатическую природу (например, основный белок миелина) или гидрофобную (например, поверхностно-активные пептиды и, возможно, фосфолипазы). На поверхности некоторых мембранных белков имеются гидрофобные домены, образующиеся благодаря особенностям вторичной или третичной структуры. Указанные поверхностные взаимодействия могут использоваться как дополнение к другим взаимодействиям, например к трансмембранному заякориванию.
3. Связывание с помощью гидрофобного "якоря"; эта структура обычно выявляется как последовательность неполярных аминокислотных остатков (например, у цитохрома 65). Некоторые мембранные белки используют в качестве якоря ковалентно связанные с ними жирные кислоты или фосфолипиды.
4. Трансмембранные белки. Одни из них пересекают мембрану только один раз (например, гликофорин), другие - несколько раз (например, лактозопермеаза; бактериородопсин).
Различиями между наружными (или периферическими) и внутренними (или интегральными) мембранными белками не задается однозначно способ их прикрепления к бислою; эти различия определяют лишь относительную силу их связывания.
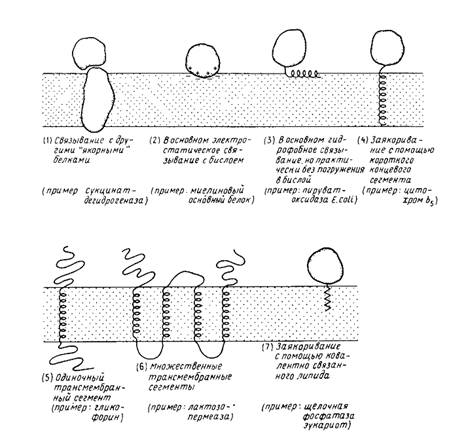
Рис. 1
Различные способы прикрепления мембранных белков к мембране. Пептидный якорь (4) может находиться либо на N-, либо на С-конце молекулы. N– и С-концы трансмембранных белков (5 и 6) могут находиться как у наружной, так и у внутренней поверхности мембраны.
2. Выделение мембранных белков
Очистка и характеристика мембранных белков ставят перед исследователем целый ряд специфических проблем, с которыми он обычно не сталкивается, работая с растворимыми белками. Мембранные белки, как правило, прочно связаны с липидным бислоем и фактически нерастворимы в воде. Поэтому для их солюбилизации и очистки приходится применять детергенты или другие разрушающие мембрану вещества. Поскольку выделение интегральных белков обычно сопряжено с разрушением мембраны, во многих случаях необходимо убедиться, что в процессе выделения и очистки белка его функциональная активность не оказалась нарушенной или утраченной. Для этого, в частности, можно попытаться провести реконструкцию,
т.е. встроить очищенный белок обратно в мембрану. Функциональную активность некоторых мембранных белков, таких, как ионные каналы или транспортные белки, можно охарактеризовать и измерить только в реконструированных мембранных системах. Для других мембранных белков, выполняющих функции ферментов или рецепторов, полезную информацию часто можно получить, используя солюбилизированные препараты. Методы солюбилизации и реконструкции не только дают ценную информацию о функциях мембранных белков; их можно также использовать для того, чтобы перевести эти белки в состояние, удобное для проведения детального структурного анализа. Несомненно, детергенты будут играть ключевую роль в совершенствовании методов кристаллизации мембранных белков для последующего рентгеноструктурного анализа.
При солюбилизации детергентами возникает вопрос о возможности избирательного извлечения из мембраны именно тех компонентов, которые интересуют исследователя. Поэтому любой новый детергент желательно проверять на возможность избирательной экстракции определенных мембранных компонентов. Ни один из имеющихся детергентов не является универсальным.
Это обусловлено тремя обстоятельствами:
1) сильными различиями в действии детергентов даже на одни и те же мембранные белки;
2) отсутствием единой стратегии солюбилизации и реконструкции;
3) сложным характером взаимодействий между молекулами белков, липидов и детергентов, имеющих столь разную химическую природу.
Существуют определенные требования к детергентам, применяемым для солюбилизации и реконструкции. Детергент должен солюбилизировать, но не денатурировать белок и должен быть легко доступен в чистом виде; желательно, чтобы детергент был недорогим.
2.1 Солюбилизация мембранных белков
2.1.1 Периферические белки
В зависимости от задачи, которая стоит перед исследователем, мембрана может быть подвергнута мягкой или жесткой обработке.
При мягких условиях обработки используют как растворы с низкой ионной силой (например, 0,1-1 мМ ЭДТА, который удаляет двухвалентные катионы), так и буферы с высокой ионной силой, содержащие NaCl и КСl в концентрации более 1 М, с добавлением ЭДТА или без нее. Не следует вводить в эти растворы такие анионы, как йодид или дииодсалицилат, поскольку они обладают хаотропнымн свойствами и могут действовать подобно детергентам. рН среды может меняться в пределах от 6,0 до 8,0. В этих условиях необратимая денатурация интегральных или периферических белков маловероятна.
При более жесткой обработке из мембран можно удалить значительные количества белка (>50% от его общего содержания в мембранах), но, с другой стороны, такая обработка обычно приводит к денатурации, во многих случаях необратимой. В качестве примера можно привести обработку мембран 6 М гуанидинийхлоридом, 8 М мочевиной, 1 мМ п-хлормер-курибензоатом, разбавленными кислотами (рН 2,0-3,0) или щелочами (рН 9,5-11,0). В кислых условиях иногда наблюдается осаждение солюбилизированных белков, и поэтому чаще прибегают к щелочной обработке.
Необходимо иметь в виду, что в результате удаления значительных количеств белка мембрана может морфологически измениться, в частности может произойти ее выворачивание или замыкание в везикулы. Поэтому следует так подобрать условия последующего центрифугирования, чтобы гарантировать полное осаждение мембран. Если используется кислотно-щелочная обработка, следует как можно быстрее вернуть рН к исходным нейтральным значениям.
2.1.2 Интегральные белки
При обработке мембран для получения интегральных мембранных белков могут высвобождаться или активироваться протеазы. Поэтому нередко на этой стадии приходится добавлять ингибиторы протеаз, даже если они уже были введены на предыдущих этапах выделения мембран. Существуют разные и довольно сложные смеси ингибиторов, которые можно использовать в зависимости от чувствительности системы к действию протеолитических ферментов. Весьма полезным, но не универсальным агентом является ингибитор сериновых протеаз, фенилметилсульфонилфторид (ФМСФ). Этот реагент хранят в концентрации 100 мМ в изопропаноле или этаноле и добавляют в инкубационную среду до концентрации 100 мкМ. Следует помнить, что он имеет довольно короткое время жизни в водных средах (ПО и 35 мин соответственно при рН 7,0 и 8,0 и 25°С). Для ингибирования SH-протеаз может оказаться полезным 10 мМ тетратионат натрия.
3. Характеристика очищенных интегральных мембранных белков
Характеристика очищенных мембранных белков, даже самых простых, может составлять определенные трудности. Как и в случае растворимых белков, нужно определить число и молекулярную массу полипептидных субъединиц, их стехиометрию, размер и, возможно, форму молекулы, а также, если это необходимо, биохимическую активность.
3.1 Определение молекулярной массы субъединиц (электрофорез в ПААГ)
Электрофорез в полиакриламидном геле в присутствии додецил-сульфата натрия - это обычная методика, но в случае интегральных мембранных белков при ее применении возникают особые проблемы. В этом методе додецилсульфат связывается с полипептидными цепями, и комплексы белок-ДНС разделяются в полиакриламидном геле в соответствии с их стоксовыми радиусами, которые в большинстве случаев зависят от молекулярной массы. Молекулярную массу определяют, сравнивая электрофоретическую подвижность данного комплекса и известного стандарта. Однако связывание ДСН с неизвестным белком может качественно отличаться от связывания со стандартами, и тогда будет получен неправильный результат. Подобная ситуация наблюдается для интегральных мембранных белков с высоким содержанием неполярных аминокислотных остатков. Возможна и другая ситуация. Связывающийся с ДСН мембранный белок может находиться в не полностью развернутом состоянии, что тоже приведет к аномальному повышению электрофоретической подвижности из-за образования более компактного комплекса белок-ДСН. Все эти эффекты весьма существенны. Например, лактозопермеаза имеет кажущуюся молекулярную массу 33 000, если измерять ее с помощью электрофореза в ПААГ в присутствии ДСН; в действительности же, как показывают результаты генетического анализа, ее молекулярная масса равна 46 000. Еще одна проблема - возможное наличие четвертичной структуры. Некоторые мембранные белки агрегируют даже в присутствии ДСН. Например, гликофорин А или белок оболочки бактериофага М13 (или fd) при электрофорезе в полиакриламидных гелях с ДСН находятся в основном в виде димеров.
Итак, оценка молекулярной массы субъединиц сильно неполярных интегральных мембранных белков, определенная с помощью электрофореза в ПААГ с ДСН, может оказаться неверной. К несчастью, простая альтернатива этому методу отсутствует, и правильную величину часто получают либо по данным о полной первичной последовательности (обычно последовательности соответствующего гена), либо с помощью точного гидродинамического анализа.
3.2 Определение молекулярной массы нативного белка с помощью гидродинамических методов
Применение этих методов для мембранных белков может быть сопряжено с большими трудностями, вызванными связыванием детергента.