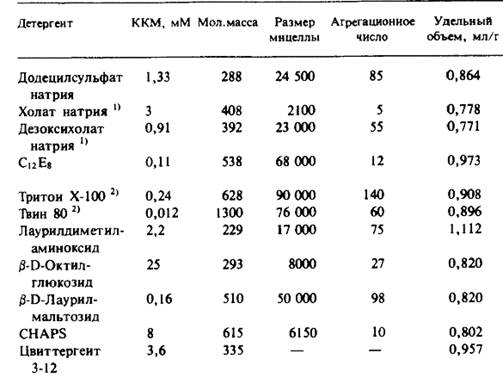
Курсовая работа: Выделение мембранных белков
1. Прямо измеряют количество связанного детергента на 1 г белка. Для этого используют спектральные методы или радиоактивно меченный детергент, а для выделения комплексов применяют различные методы, например гель-фильтрацию. Установив относительное содержание белка и детергента в комплексе, cреднее значение парциального удельного объема получают как средневзвешенное соответствующих величин для чистого белка и чистого детергента. После этого без труда находят Mк, а поскольку соотношение между белком и детергентом в комплексе известно, находят молекулярную массу белка.
2. Измеряют S0 (коэффициент седиментации) в средах с разными значениями плотности раствора ρ. Такие среды обычно получают, используя смеси Н2О и D2O. Из графика зависимости S0 от ρ находят как Mк, так и Vк (ср). При этом предполагается, что Vк - это средневзвешенное соответствующих величин для чистого белка и чистого детергента.
Vк(ср) = (Доля белка) • V(ср) белок + (Доля детергента) • V(ср) детергент.
Оценив V(ср) белок и взяв V(ср) детергент из таблицы, получают молекулярную массу белковой составляющей Mк.
Для построения графика зависимости S0 от ρ проводят аналитическое центрифугирование. Можно проводить центрифугирование и в градиенте плотности сахарозы, используя смеси Н2О и D2O, но анализ результатов в этом случае гораздо сложнее, хотя принципиально не отличается от предыдущего случая.
3.3 Метод радиационной инактивации
Метод радиационной инактивации для определения размера мишени все чаще применяется при исследовании мембранных белков. Изучать можно как очищенные белки, так и неочищенные препараты, в том числе интактные биомембраны. Суть метода состоит в определении доли белковых молекул, получающих повреждения при облучении. Для этого используют ферментативные методы связывания гормонов или других лигандов или спектральные методы. Процедура состоит в следующем. Образец, обычно замороженный, подвергают высокоэнергетическому облучению (например, облучают пучком электронов из синхротрона). Через разные промежутки времени отбирают пробы, размораживают их и проводят измерения. Повреждения белка под действием излучения (в частности, разрыв ковалентных связей) выявляют, например, с помощью электрофореза в ПААГ с ДСН. Как показывает опыт, некоторые субъединицы полностью утрачивают биологическую активность при внесении радиационного повреждения в любое место полипептидной цепи. Ключевым моментом является то, что, чем крупнее белковая молекула, тем больше вероятность ее повреждения и, следовательно вероятность инактивации. Эта вероятность зависит не от формы молекулы, а от ее массы. Обычно для того, чтобы облегчить интерпретацию результатов, параллельно облучают белок с известной молекулярной массой. Если исследуемый белок содержит более одной субъединицы, возникают определенные трудности при анализе результатов.
3.4 Спектральные методы
Для определения содержания α - спиралей и β - слоев в мембранных белках используют несколько методов. В отсутствие трехмерной организации на их основе можно попытаться построить соответствующие модели. Чаще всего используется метод кругового дихроизма (КД). Все более широкое применение находят инфракрасная и рамановская спектроскопия, а также ЯМР.
3.4.1 Метод кругового дихроизма
Метод основан на измерении разности поглощения лево - и правополяризованного света; эта оптическая активность является мерой хиральности молекул, или мерой их асимметрии. В дальней ультрафиолетовой области (от 190 до 240 нм) КД определяется в основном поглощением амидов карбонильных групп полипептидного остова. При наличии участков вторичной структуры, например α-спиралей, спектр КД имеет вполне определенные особенности, связанные с особенностями электронного окружения амидных групп в этих структурах. Анализируя спектр КД белков, его обычно представляют как сумму компонентов, отвечающих поглощению разных участков белковой молекулы: α-спиралей, β-слоев и случайных клубков. Определив тем или иным способом спектры каждой из этих структур, производят их суммирование, подбирая соответствующие коэффициенты таким образом, чтобы было достигнуто наилучшее соответствие измеренному спектру. Подобранные весовые коэффициенты представляют собой ту долю, которая приходится в молекуле на каждый из типов вторичной структуры.
Эти методы были разработаны для растворимых белков, но нет никаких оснований сомневаться, что их можно с успехом применять и для мембранных белков. Скорее всего, у последних имеются участки с такими же типами вторичной структуры, как и у растворимых белков, и при их изучении возникнут такие же трудности. Некоторые белки можно изучать in situ, используя суспензии мембран. Примерами такого рода являются бактериородопсин из пурпурной мембраны Halobacterium halobium и Са2 + - АТР-аза из мембраны саркоплазматического ретикулума. Очищенные мембранные белки можно исследовать с помощью КД и в присутствии детергентов, если поглощение последних в дальней УФ-области не слишком велико, или в составе реконструированных везикул. Здесь возникают две проблемы:
1) дифференциальное светорассеяние, когда размер мембранных частиц гораздо больше длины волны света;
2) выравнивание поглощения из-за концентрирования белка в мембранах или везикулах, т.е. из-за негомогенности его распределения в растворе. Эти артефакты могут быть весьма существенными, однако их можно учесть с помощью соответствующих методов.
К сожалению, для внутренних мембранных белков отсутствуют структурные данные высокого разрешения, поэтому точная интерпретация спектров КД невозможна. За исключением нескольких случаев, разные спектральные методы не использовались для изучения одного и того же белка и количественное сравнение результатов не проводилось. Интересно, что для бактериородопсина, который исследовали методами КД, ИК и ЯМР, во всех трех случаях были получены одинаковые результаты, свидетельствующие о значительном содержании в этом белке β-слоев. Тем не менее у каждого метода имеются существенные недостатки. Так, данные о высоком содержании в бактериородопсине β-слоев (-46%) в значительной мере зависят от способа учета оптических артефактов. Судя по данным электронно-микроскопической реконструкции, характеризующимся относительно низким разрешением, в бактериородопсине 80% приходится на долю α-спиралей, а β-слои отсутствуют совсем. Чтобы понять причину этих несоответствий, необходимо провести структурный анализ белка с атомным разрешением.
3.4.2 Инфракрасная спектроскопия и спектроскопия комбинационного рассеяния
Эти методы не только позволяют получить сведения о конформации мембранных липидов, но и могут использоваться для исследования вторичной структуры белков. Колебательный спектр полипептидного остова зависит от типа вторичной структуры и дает информацию о содержании в молекуле α - и β - структур. Этими методами можно исследовать высушенные на воздухе пленки, водные суспензии мембран, а также очищенные белки как в присутствии детергента, так и в составе реконструированных везикул.
3.4.3 ЯМР-спектроскопия
Этот метод также может использоваться для изучения мембранных белков. Однако возможности метода в этом случае ограничены, что связано главным образом с относительно медленными движениями интегральных мембранных белков insitu и в комплексах с детергентом.
3.5 Определение ферментативной активности
Одним из наиболее важных методов характеристики очищенных мембранных белков несомненно является определение биохимической активности. При этом используются в основном такие же критерии, как и для растворимых белков, но могут возникать и свои трудности. Первая из них связана с тем, что биохимическая активность мембранных белков часто очень сильно зависит от связывания с белком липидов и детергентов. Потеря активности может быть как обратимой, так и необратимой. Целесообразно иметь какую-то оценку удельной активности исследуемого белка in vivo или в составе мембран до солюбилизации. Избыток детергента может оказывать ингибирующий эффект, например за счет разбавления неполярных субстратов в популяции мицелл и уменьшения ферментативной активности. Измеряя активность любого мембранного белка, необходимо иметь в виду, что in situ он находится в окружении липидов, обеспечивающих оптимальную активность. Вторая проблема связана с белками, обладающими "трансбислойной" активностью; примерами могут служить белки, образующие каналы, и транспортные белки. В этих случаях необходимо учитывать перемещение растворенных веществ из одного компартмента в другой (например, внутрь липосом и наружу).
3.6 Изучение стехиометрии субъединиц
Многие мембранные ферменты представляют собой комплексы, состоящие из нескольких субъединиц. В качестве примера можно привести Н + - АТРазу, Na +/ К + - АТРазу, митохондриальные комплексы электронного транспорта и фотосинтетические реакционные центры. Некоторые интегральные мембранные белки прочно связаны с растворимыми белками с помощью нековалентных взаимодействий (примерами могут служить Fo - и F1-компоненты митохондриальной Н + - АТРазы). В Е. сoliFo-компонент, содержащий по данным электрофореза в ПААГ-ДСН три типа субъединиц (а, b, с), образует протонный канал, aF1, состоящий из пяти типов субъединиц, содержит активный центр, участвующий в гидролизе АТР. Для таких белков очень важно определить характер субъединиц, стехиометрию комплекса и ближайшие взаимодействия его компонентов. Это весьма непростая задача даже тогда, когда белковый комплекс уже изолирован. Возникающие здесь проблемы по существу не отличаются от таковых для растворимых белковых комплексов, но имеются и свои дополнительные сложности.
Прежде всего следует иметь в виду, что взаимодействие между субъединицами очень сильно зависит от типа липидов и детергентов, с которыми связаны белки.
Еще одна проблема связана с тем, что в бислое мембранные белки могут образовывать комплексы из-за высокой их локальной концентрации. При солюбилизации же независимо от используемого детергента может произойти разбавление мембранных белков и их разъединение. По закону действующих масс это приведет к диссоциации комплексов, в которых взаимодействие между компонентами не очень сильное.
Для изучения стехиометрии субъединиц и их ассоциации в очищенном комплексе используется всего несколько методов:
1) химическое сшивание;
2) количественный анализ N-концевых аминокислот;
3) определение отношения массы субъединиц в ДСН-полиакриламидных гелях путем определения интенсивности окрашивания, с помощью радиоавтографии или иммуноблоттинга.
Каждый метод имеет свои ограничения, но все они использовались на практике.
3.7 Изучение трехмерной структуры с помощью рентгеновской дифракции и реконструкции изображения
3.7.1 Кристаллизация мембранных белков
Наиболее детальную структурную информацию об очищенных мембранных белках можно получить, исследуя методом рентгеновской дифракции трехмерные белковые кристаллы. К сожалению, оказалось, что интегральные мембранные белки очень трудно кристаллизовать. Будучи удалены из своего естественного липидного окружения, неполярные участки липидных молекул склонны агрегировать с образованием неупорядоченных форм, непригодных для кристаллографического анализа. Ясно, что необходимы специальные методы, позволяющие обойти эти трудности, и в этом был достигнут определенный прогресс. Михель обратил внимание, что мембранные белки образуют кристаллы двух типов (рис.2).
Кристаллы типа I напоминают стопки мембран. В них осуществляется латеральное взаимодействие между неполярными участками, а мембраноподобные слои связывают полярные участки белков. Подобные кристаллы были получены для нескольких белков, но ни в одном случае их нельзя было исследовать с помощью дифракции с высоким разрешением. Кристаллы типа II стабилизируются за счет контактирования полярных участков белковых молекул, а небольшие амфифильные соединения или детергенты в основном заполняют промежутки между ними. Заметим, что очень важными являются размер, заряд и другие свойства детергентов; если эти параметры неблагоприятны, то детергент может дестабилизировать кристаллическую структуру. Кристаллы типа II образуют белки фотосинтетического реакционного центра Rhodopseudomonas viridis
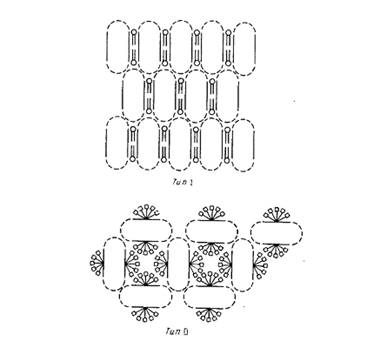
Рис.2. Два основных типа кристаллов мембранных белков.
Кристаллы типа I представляют собой двумерные стопки, упорядоченно расположенные в третьем измерении. В кристаллах типа II с гидрофобными поверхностями белков связаны молекулы детергента. Пунктиром отмечены гидрофильные домены белков.