Лабораторная работа: Получение коллоидных растворов
Ход работы: Собирают установку согласно рис. 4. В первую U–образную трубку (1) наливают раствор Na2 S, во вторую – раствор Na2 SO3 и 0,5 мл раствора NaOH (2). Правое колено второй трубки закрывают пробкой с хлоркальциевой трубкой, в которой находится активированный уголь (3). В пробирку Вюрца (4) насыпают кристаллический KMnO4 (одну или две ложечки для сжигания), приливают концентрированный раствор соляной кислоты немного выше уровня кристаллов соли и быстро закрывают пробирку пробкой (5). Выделяющийся во время химической реакции хлор проходит сначала в первую U-образную трубку. В толще раствора появляется сера. Затем хлор поступает во вторую U-образную трубку. Чтобы доказать, что здесь образовался продукт окисления – сульфат натрия, нужно внести раствор хлорида бария, проткнув иглой шприца резиновую трубку, (образуется осадок белого цвета). Затем добавить из шприца раствор соляной кислоты для растворения возможно образовавшегося BaSO3 . Если осадок не растворяется, следовательно, в результате химической реакции хлор окисляет сульфит-ион до сульфат-иона.
Уравнения реакций:
2KMnO4 + 16HCl® 2MnCl2 + 5Cl2 + 8H2 O + 2KCl;
Na2 S + Cl2 ® S¯ + 2NaCl;
Na2 SO3 + Cl2 + 2NaOH ® Na2 SO4 + 2NaCl + H2 O;
Na2 SO4 + BaCl2 ® BaSO4 ¯ + 2NaCl; Na2 SO3 + BaCI2 = BaSO3 ↓+ 2NaCI
BaSO4 ¯ + HCl --/®
BaSO3 ↓+ 2HCl ® BaCl2 + H2 SO3 ; H2 SO3 ® SO2 + H2 O.
Примечание: Чтобы взаимодействие KMnO4 с HCl шло энергичнее, можно пробирку немного подогреть.
Техника безопасности: Установку мыть под вытяжкой, сполоснув предварительно емкости щелочным раствором.
Утилизация. В пробирке-реакторе получают хлор из перманганата калия. Переработка этой смеси показана выше (тема “Галогены”, VIII кл.). В первой на пути хлора U-образной трубке образуется сера. После эксперимента трубку залить слабым щелочным раствором, дать отстояться сере, затем слить надосадочную жидкость в кристаллизатор. Отделить серу фильтрованием, промыть и высушить. Все промывные воды слить в раковину. Во второй U-образной трубке идет процесс окисления сульфита натрия до сульфата.
Для обнаружения сульфат-анионов в трубку добавляется раствор хлорида бария и соляная кислота. Образовавшуюся токсичную смесь слить после опыта в емкость-нейтрализатор.
Опыт № 5. Окислительные свойства азотной кислоты по отношению к сульфид и сульфит ионам
Оборудование и реактивы: Раствор HNO3 (1:1), растворы (5%) NaOH, Na2 SO3 , BaCl2 , HCl, пробирки демонстрационные, две пробки со стеклянными трубками и активированным углем.
Ход работы: 1) К раствору Na2 S (0,5-1 мл) добавить такой же объем раствора HNO3 (1:1). Пробирку закрыть пробкой с активированным углем. Через некоторое время наблюдается постепенное образование серы в толще раствора. Процесс идет без образования токсичных газообразных продуктов восстановления азотной кислоты:
2HNO3 + Na2 S ® S¯ + NaNO2 + H2 O + NaNO3 .
2) К раствору Na2 SО3 (0,5-1 мл) прилить такой же объем раствора HNO3 , затем добавить 0,1 мл раствора щелочи. Процесс идет без выделения токсичных газообразных продуктов восстановления азотной кислоты:
Na2 SO3 + HNO3 + NaOH ® Na2 SO4 + NaNO2 + H2 O.
Для обнаружения полученного сульфата натрия через 1-2 минуты в пробирку добавить раствор BaCl2 и раствор HCl. Сохранение осадка в кислой среде свидетельствует об образовании сульфат-иона в ходе реакции.
Утилизация: Содержимое пробирки (1) нейтрализуют после опыта вначале суспензией, а затем раствором гидроксида кальция с фенолфталеином до слабой малиновой окраски. Отфильтровать серу, промыть и высушить на воздухе. Фильтрат сильно разбавляют и используют в качестве азотных удобрений на пришкольном участке. В содержимое пробирки (2) в ходе опыта добавляют хлорид бария с соляной кислотой. Получается смесь с токсичными соединениями бария, поэтому жидкость с осадком переносят в емкость- нейтрализатор.
Опыт № 6. Эндотермические реакции
Оборудование и реактивы: Прибор для электролиза, две пробирки, два кристаллизатора, раствор NaOH (массовой долей 5-8 %), изогнутые газоотводные трубки, железные электроды.
Ход работы: Примером эндотермической реакции может стать разложение воды электрическим током. Собирают установку согласно рис. 5. U-образную трубку заполнить на 2/3 объема раствором NaOH, закрыть отверстия трубки пробками с железными электродами.
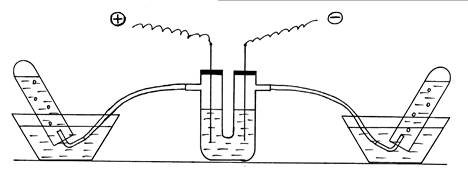
Рис. 5. Демонстрация эндотермической реакции разложения воды.
Две пробирки наполняют дистиллированной водой и опрокидывают вверх дном в кристаллизаторы с водой. В пробирки подводят изогнутые газоотводные трубки от электролизера. Прибор подключают к источнику тока. Наблюдают образование и накопление газов в пробирках (следует обратить внимание на соотношение их объемов). Отключить внешний источник энергии, реакция разложения заканчивается без подвода внешней энергии. Написать уравнение электролиза раствора NaOH.
Утилизация. Раствор щелочи в U-образной трубке использовать повторно, добавив более концентрированный раствор NaOH (контроль по показаниям ареометра).
ЛАБОРАТОРНАЯ РАБОТА № 2
Опыт № 1. Получение комплексных соединений
Оборудование и реактивы: Пробирки, разбавленные растворы: AlCl3 , NaOH, AgNO3 , NH4 OH, NaCl, CuSO4 , раствор NaCl насыщенный, NH4 OH (конц.).
Ход работы: Провести химические процессы согласно уравнениям реакций:
1). AlCl3 + 3NaOH®Al(OH)3 ↓ + 3NaCl--- добавляют раствор щелочи в недостатке.
Al(OH)3 ↓ + NaOH®Na[Al(OH)4 ] --- добавляют раствор щелочи в небольшом избытке.