Лабораторная работа: Получение коллоидных растворов
2AgOH↓®Ag2 O + H2 O --- наблюдают частичное самопроизвольное разложение AgOH, смесь темнеет.
Ag2 O + 4NH4 OH®2[Ag(NH3 )2 ]OH + 3H2 O -- добавляют избыток концентрированного раствора гидроксида аммония. Получили «аммиачный раствор оксида серебра».
3). AgNO3 + NaCI®AgCl↓ + NaNO3 -- используют предельно разбавленные растворы исходных веществ. Хлорид серебра должен получиться в виде суспензии, а не творожистого осадка. К небольшой части этой суспензии (0,5–1 мл) добавить избыток насыщенного раствора хлорида натрия. Наблюдают растворение осадка:
AgCl↓ + NaCl®Na[AgCl2 ]
Последняя реакция может проводиться на кафельной пластине.
4). CuSO4 + 2NH4 OH®Cu(OH)2 ↓+ (NH4 )2 SO4 --- добавляют недостаток разбавленного раствора гидроксида аммония.
Cu(OH)2 ↓+ 4NH3 ® [Cu(NH3 )4 ](OH)2 – гидроксид тетраамминмеди (II); (добавляют избыток концентрированного раствора аммиака).
Или: CuSO4 + 4NH3 ® [Cu(NH3 )4 ]SO4 --- сульфат тетраамминмеди (II) синего цвета.
Утилизация. Полученный аммиакат меди оставить для демонстрации опыта “Разложение перекиси водорода” в качестве катализатора. Избыток аммиаката меди, накопленный в лаборатории, слить в стакан, добавить малыми порциями раствор серной кислоты массовой долей 5-10% (Осторожно! Сильное разогревание!). Происходит разрушение аммиаката, раствор приобретает голубую окраску сульфата меди. Полученную смесь сульфата меди и сульфата аммония можно использовать вновь для демонстрации получения аммиаката меди. Для этого следует добавить в емкость раствор щелочи. После нейтрализации раствора кислоты, система приобретает вновь синее окрашивание.
В пробирку с тетрагидроксоалюминатом натрия пропустить углекислый газ, выпадает осадок Al(OH)3 : Na[Al(OH)4 ] + CO2 = Al(OH)3 ↓+ NaHCO3 .
Осадок промыть и высушить. Аналогично утилизируют раствор Na2 [Zn(OH)4 ] при получении комплексного соединения из гидроксида цинка: Na2 [Zn(OH)4 ]+ 2CO2 = Zn(OH)2 ↓ + 2NaHCO3 .
Комплексное соединение серебра – аммиачный раствор оксида серебра в дальнейшем использовать в качестве реактива для обнаружения альдегидов. Дихлороаргентат натрия поместить в склянку для сбора серебросодержащих остатков.
Опыт № 2. Каталитическое разложение пероксида водорода в присутствии ионов меди, аммиаката меди и каталазы
Оборудование и реактивы: Пробирки, раствор перекиси водорода (10%), раствор сульфата меди (5%), раствор аммиаката меди, раствор каталазы (мясная или картофельная вытяжка).
Ход работы: Для проведения опыта необходимо приготовить растворы каталазы и аммиаката меди. Для приготовления каталазы необходимо свежий мясной фарш залить водой, тщательно перемешать и отжать. Отжатую жидкость профильтровать, фильтрат использовать для опыта. Для приготовления аммиаката меди нужно к раствору сульфата меди (II) прилить избыток концентрированного раствора аммиака:
CuSO4 + 4NH3 ® [Cu(NH3 )4 ]SO4 --- сульфат тетраамминмеди (II).
В три пробирки с раствором перекиси водорода (по 1 мл) добавляют: в первую – 0,2 мл раствора CuSO4 , во вторую – несколько капель раствора [Cu(NH3 )4 ]SO4 , в третью – 0,2 мл «раствора» каталазы. Наблюдают разную каталитическую активность веществ, используемых в качестве катализаторов.
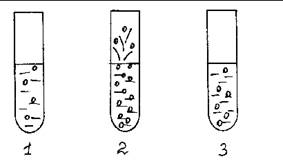
Рис. 6. Каталитическое разложение H2 O2 .
Техника безопасности. Не допускать попадания раствора перекиси водорода на кожу и одежду. Осторожно добавлять аммиакат меди к перекиси водорода. Реакция идет бурно.
Утилизация. Все растворы в пробирках перенести в емкость–нейтрализатор.
Опыт № 3. Экзотермические реакции
Оборудование и реактивы: Пробирка или железная банка, сульфат меди (кристал.), железный порошок, вода, стеклянная палочка.
Ход работы: В пробирку или железную банку внести хорошо перемешенные сульфат меди и железный порошок в соотношении количества вещества 1:1. Смесь смочить водой до кашицеобразного состояния и перемешать стеклянной палочкой. Пробирка сильно нагревается за счет тепла экзотермической реакции: CuSO4 + Fe®FeSO4 + Cu.
Утилизация. Растворить смесь в воде. Отфильтровать. Осадок металлического железа с медью высушить, поместить в сухую склянку и герметично закрыть пробкой. Смесью металлов можно воспользоваться для демонстрации коррозии контакта Fe–Cuв нейтральной или слабокислой среде.
Для этого: а) Немного смеси внести в пробирку с водой на 1 – 2 суток. Появляются бурые продукты коррозии:
А- ôFe0 – 2 ē®Fe2+ ;
К+ ôСuô 2H2 O + 4ē + O2 ® 4 OH-
Далее: Fe2+ + 2OH- ®Fe(OH)↓2 ; 4 Fe(OH)2 ↓ + O2 + 2H2 O® 4Fe(OH)↓3 .
б) Немного смеси внести в очень слабый раствор соляной кислоты. Через некоторое время также образуется бурый осадок:
А- ôFe0 – 2 ē®Fe2+ ; К+ ôCuô 2H+ + 2ē ®H2 ;