Научная работа: Клеточные и молекулярные механизмы депривационных изменений
Влияние импульсной активности на строение коры
Эксперименты со зрительной депривацией в ранние периоды жизни подняли две различные, но взаимосвязанные проблемы. Во-первых, каким образом проявляются эффекты импульсной активности на паттерны роста и ретракции отростков нейронов? Во-вторых, каким образом согласованная или несогласованная активность двух различных нервных путей определяет то, как они конкурируют за территорию и определяют ее границы?
В экспериментах, выполненных на котятах, была показана роль потенциалов действия в изменении архитектуры зрительной коры. Когда производится закрытие глаза или животное содержится в полной темноте, это не приводит к полному прекращению активности в зрительных путях. Нейроны продолжают спонтанно генерировать сигналы, и колонки глазного доминирования развиваются как отделенные друг от друга зоны.
Эксперименты, выполненные Страйкером, Шатц и их коллегами, показали, что этот, одинаково низкий уровень активности, идущий от обоих глаз, очень важен для нормального развития. Для доказательства этого они вводили тетродотоксин (TDC), который блокировал проведение потенциалов действия, в оба глаза новорожденного котенка. Через несколько дней после удаления токсина проведение в зрительных путях от сетчатки к коре через ЛКТ восстанавливалось. Интересным результатом оказалось то, что после восстановления в латеральном коленчатом теле не происходило разделения
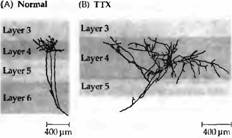
Рис. 1. Увеличение ветвистости волокон ЛКТ заканчивающихся в слое 4 зрительной коры, после аппликации тетродотоксина в оба глаза. (А) Нормальная ветвистость помеченных аксонов из ЛКТ в слое 4 (в возрасте 30 дней). (В)
импульсов, идущих от разных глаз, в разные слои. Более того, клетки в слое 4 зрительной коры по-прежнему управлялись обоими глазами, как у новорожденного животного, и колонки глазного доминирования, выявленные методом авторадиографии, имели неонатальный паттерн: они сильно перекрывались и не имели четких границ. Таким образом, при полном отсутствии активности волокна из ЛКТ не могут подвергаться нормальной ретракции в слое 4 коры (рис. 1 и 2).
Влияние закрытия век на формирование глазодоминантных колонок может сильно меняться, если заблокировать активность клеток коры при помощи ТТХ.
Например, проводили введение ТТХ на протяжении нескольких дней в зрительную кору котенка во время критического периода развития при депривации одного глаза.
После удаления ТТХ кортикальные клетки продолжали отвечать на стимуляцию обоих глаз, хотя один глаз был депривирован. Также в отсутствие активности не происходила ректракция отростков. Вместо использования ТТХ Страйкер с коллегами применяли фармакологические агенты, избирательно ингибирующие корковые нейроны, но не блокирующие активность в афферентных волокнах, идущих из ЛКТ.
Полученные ими результаты в опытах с одновременной монокулярной депривацией дают основания полагать, что активность постсинаптических клеток определяет, возникнет ли ретракция после проведения монокулярной депривации.
Таким образом, важным является не просто наличие исходящей из глаз активности.
Синхронизованная спонтанная активность при отсутствии стимуляции во время развития
Эксперименты с тетродотоксином показывают, что для ретракции аксонов необходимо, чтобы по зрительным путям передавалась активность в виде потенциалов действия. Без этой фоновой активности аксоны остаются разветвленными в нескольких слоях ЛКТ и пересекают границы глазодоминантных колонок в коре. Итак, как мы уже видели, большая часть развития нервной системы проходит еще до момента рождения. В темноте утробы матери, еще до того, как котенок или детеныш обезьяны что-то увидят, и даже еще до того, как фоторецепторы начнут функционировать, уже можно различить отдельные слои в ЛКТ и колонки в коре. Означает ли это, что раннее развитие происходит без активности потенциалов действия, или какая--то собственная импульсная активность внутри системы управляет этим развитием?
Мафей с коллегами продемонстрировали, что синхронные разряды потенциалов действия распространяются вдоль глазного нерва уже в матке. Были многочисленные дискуссии по поводу того, каким образом эта активность может возникать и какую роль она может играть в формировании согласованных полей иннервации.
То, что имеются периодические, синхронизованные волны активности в соседних ганглиозных клетках, было показано Майстером, Байлором и их коллегами в сетчатках, выделенных у незрелых хорьков и плодов котят. Сетчатка помещалась в камеру, в которой находился 61 электрод. В записях с каждого электрода можно было идентифицировать разряды до четырех различных ганглиозных клеток. В этих опытах было выявлено, что определенный паттерн активности распространяется по сетчатке от одной

Рис. 2. Волны импульсной активности, распространяющиеся вдоль изолированного препарата сетчатки новорожденного хорька.
ганглиозной клетке к другой. Пример показан на рис. 2. Изолированная сетчатка была помещена на матрицу регистрирующих электродов. Расположение каждого из 82 нейронов показано в виде маленькой черной точки. Электрически активные нейроны показаны в виде больших черных пятен, размер которых пропорционален частоте импульсации. Каждый кадр представляет собой усредненную нейронную активность за 0,5 секунды. На протяжении восьми кадров (3,5 с) потенциалы действия начинаются в области одной маленькой группы клеток и распространяются на всю сетчатку. Вскоре после прохождения первой волны начинается вторая, затем еще одна, каждый раз распространяясь в разных направлениях. На этом этапе развития фоторецепторы хорька еще не способны отвечать на свет.
Маленькими точками показано расположение электродов, большими черными точками отмечены места разрядов потенциалов действия, размер точки показывает частоту разрядов. Расстояние между кадрами составляет 0,5 с. Волна активности распространяется вдоль сетчатки на протяжении примерно 3 секунд. Обычно такие волны повторяются через определенные периоды, разделенные интервалами примерно в 2 секунды. Вонгсообщил о схожем волноподобном распространении кратковременных изменений в концентрации внутриклеточного кальция и предположил, что это может играть роль в синхронизации электрической активности. Имеются свидетельства, что холинэргические нейроны, звездчатые амакриновые клетки и имеющиеся между клетками электрические контакты играют роль в генерации координированной активности ганглиозных клеток незрелой сетчатки.
Однако до сих пор остается неизвестным, каким образом синхронизованная активность в одном глазу приводит к разделению идущих от него волокон зрительного нерва в слоях ЛКТ и препятствует перекрытию этих слоев.
Клеточные механизмы пластичности соединений
Для того, чтобы проверить, каким образом активность влияет на рост и ретракцию нервных отростков, было проведено много экспериментов на культурах нейронов позвоночных и беспозвоночных. Например, серии потенциалов действия, вызванные электрической стимуляцией с разной частотой, как было показано, приводят к значительной ретракции отростков, которые затем снова отрастают. Более того, этот эффект зависел не только от частоты и продолжительности серий, но и от молекулярного окружения, в котором происходил рост нейронов, а также от стадии их роста.
Эксперименты с искусственным косоглазием показывают, что для того, чтобы соединения между нейронами поддерживались на функциональном уровне, нейроны должны каким-то образом определять, какой из двух входящих сигналов находится в фазе, а какой — нет. Регистрации сигналов от кортикальных нейронов показывают, что нейроны способны отвечать со значительно большей амплитудой на два исходящих синоптических сигнала, которые поступают с определенной синхронностью. Каким образом это может привести к тому, что в результате одни нервные окончания остаются, а другие подвергаются ретракции, остается неизвестным.
Роль трофических веществ в поддержании нейронных связей
Отдельным направлением исследований является оценка того, каким образом трофические вещества, секретируемые постсинаптическими клетками-мишенями, участвуют в поддержании нейронных связей. Мафей с коллегами первыми показали в своих экспериментах, что нейротрофины, такие как ФРН (фактор роста нерва, NGF, nervegrowthfactor) и МНФ (мозговой нейротрофический фактор, BDNF, brain-derivedneurotrophicfactor), могут предотвращать эффекты монокулярной депривации в развивающейся зрительной системе крыс. Их результаты дают основания предполагать, что волокна ЛКТ конкурируют за факторы роста.
Предположение авторов заключалось в том, что аксоны, не получая достаточного количества факторов роста от клеток мишеней, теряют с ними связи и подвергаются ретракции, как это происходит в других системах. В связи с этим был проведен ряд опытов, в которых в коре крысы создавали высокую или избыточную концентрацию ФРН либо при помощи непосредственного введения, либо при помощи секреции из имплантированных специально культивированных шванновских клеток. В этих условиях монокулярная депривация больше не приводила к уменьшению размера колонок, однако кортикальные клетки по прежнему получали управление от обоих глаз. Введение антител к ФРН предотвращало эти эффекты.
Более того, в нормально развивающейся зрительной системе антитела к ФРН вызывали уменьшение клеток в размерах и продлевали критический период, как должно происходить в случае блокады нормального действия трофических факторов и ФРН.
Хотя постепенно появляется все больше информации о локальных различиях в молекулярном окружении и о некоторых свойствах самих нейронов, до настоящего времени не существует полного и обстоятельного объяснения механизмам критического периода и пластичности на молекулярном уровне.
Таким образом, мы пока не можем объяснить, почему соединения в зрительной коре являются более уязвимыми, чем в сетчатке или в спинном мозге.
--> ЧИТАТЬ ПОЛНОСТЬЮ <--