Научная работа: Контроль якості препаратів, що містять йод
У зв’язку з цим досить актуальним є контроль якості препаратів, що містять Йод. Згідно аналітичної нормативної документації, аналіз препаратів проводять методом потенціометрії з використанням срібного індикаторного електроду або з використанням рідинної хроматографії.
???????? ???? ????????? ???????? ? ?????? ?????????? ? ?????????? ???????????? ??????????, ???? ?????????? ???? ????????? ????? ?????? ?? ???????? ???????? ???????? ?????? ??????????, ?? ??????? ???.Розділ 1. Загальні відомості про Йод
1.1. Опис елемента
 Рис. 1
Рис. 1
Йод – хімічний елемент VII групи періодичної системи Менделєєва. Атомний номер - 53. Відносна атомна маса 126,9045 (рис. 1). Галоген. З наявних у природі галогенів – найважчий, якщо, звичайно, не вважати радіоактивний короткоживучий астат. Практично весь природний Йод складається з атомів одного – єдиного ізотопу з масовим числом I127 , його вміст у земній корі 4 * 10-5 % по масі. Радіоактивний Йод I125 утвориться в ході природних радіоактивних перетворень. Зі штучних ізотопів Йоду найважливіші – Йод I131 і Йод I133 . їх в основному використовують у медицині.
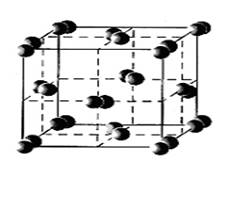 Рис. 2
Рис. 2
I2 – галоген. Темно-сірі кристали з металевим блиском. Летучий. Погано розчиняється у воді, добре – в органічних розчинниках (з фіолетовим чи коричневим фарбуванням розчину) чи у воді з добавкою солей – Йодидів. Слабкий окислювач і відновник. Реагує з концентрованими сірною й азотною кислотами, металами, неметалами, лугами, сірководнем. Утворює сполуки з іншими галогенами.
Молекула елементного Йоду, як і інших галогенів, складається з двох атомів. Йод – єдиний з галогенів – знаходиться у твердому стані при нормальних умовах. Красиві темно – сині кристали Йоду більше всього схожі на графіт. Чітко виражена кристалічна будівля (рис. 2), здатність проводити електричний струм – усі ці «металеві» властивості характерні для чистого Йоду.
1.2. Електронно-графічна формула Йоду
Конфігурація зовнішніх електронів атома Йоду 5s2 5p5. Відповідно до цього виявляє в сполуках перемінну валентність (ступінь окислювання): -1 (у HI, KI) (рис. 3); +1 (у HIO, KIO) (рис. 3); +3 (в IСl3 ) (рис. 4); +5 (у НIO3 , КIO3 ) (рис. 5); і +7 (у HIO4 , KIO4) (рис. 6).
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
|
|
|
Рис.3
![]()
![]()
![]()
![]()
![]()
![]()
![]()
|
|
|
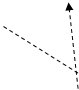 | ||
Рис.4
![]()
![]()
![]()
![]()
![]()
![]()
|
|
|
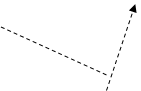 | |||
Рис.5
![]()
![]()
![]()
![]()
![]()
|
|
|
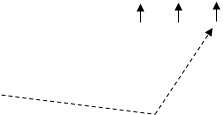 |
Рис.6
1.3. Фізичні властивості Йоду
Густина Йоду = 4,94 г/см3 , tпл = 113,5 °С, tкип = 184,35 °С. Молекула рідкого і газоподібного Йоду складається з двох атомів (I2 ). Помітна дисоціація I2 = 2I- спостерігається вище 700 °С, а також при дії світла. Уже при звичайній температурі Йод випаровується, утворюючи різко фіолетову пару з різким запахом. При слабкому нагріванні Йод возгоняється, осідаючи у виді блискучих тонких пластинок; цей процес служить для очищення Йоду в лабораторіях і в промисловості. Йод погано розчинний у воді (0,33 г/л при 25 °С), добре - у сірковуглеці й органічних розчинниках (бензолі, спирті), а також у водяних розчинах Йодидів.
1.4. Хімічні властивості Йоду
Хімічно Йод досить активний, хоча й у меншому ступені, ніж хлор і бром.
З металами Йод при легкому нагріванні енергійно взаємодіє, утворюючи Йодиди.
Hg + I2 = HgI2
З воднем Йод реагує тільки при нагріванні і не цілком, утворюючи йодистий водень.
I2 + H2 = 2НI
Елементний Йод - окислювач, менш сильний, ніж хлор і бром. Сірководень H2 S, тіосульфат натрію Na2 S2 O3 і інші відновлювачі відновлюють його до I- .
I2 + H2 S = S + 2НI
Хлор і інші сильні окислювачі у водяних розчинах переводять його в IO3 - .
При розчиненні у воді Йоду частково реагує з нею;
I2 + H2 O = HI + HIO
У гарячих водяних розчинах лугів утворяться Йодид і Йодат.
I2 + 2KOH = KI + KIO + H2 O
3KIO = 2KI + KIO3
При нагріванні йод взаємодіє з фосфором: