Реферат: Адсорбция и адсобционные равновесия
Эти соотношения показывают, что, зная изотерму при одной температуре, можно рассчитать изотерму при другой температуре. В дальнейшем теорию Поляни разработал М.М. Дубинин. Так, им обнаружено важное свойство, характерное для потенциальных кривых адсорбции : характеристические кривые для одного и того же адсорбента и разных адсорбатов при всех значениях объемов адсорбата в поверхностном слое находятся в постоянном соотношении b , т.е.
( e / e 0 ) V = b - коэффициент аффинности, где e 0 – адсорбционный потенциал для адсорбата, выбранного за стандарт.
Используя теорию Поляни и обобщив экспериментальный материал, Дубинин пришел к выводу о возможности применения функции распределения Вейбулла Q = f ( V ) в качестве функции распределения адсорбционного объема по значению потенциала для описания адсорбции на микропористых адсорбентах. Применительно к распределению степени заполнения по адсорбционному потенциалу функцию распределения Вейбулла представляют соотношением
q = f ( C ) .
Это выражается следующим образом:
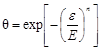 ,
,
где E , n - параметры, не зависящие от температуры;
e - адсорбционный потенциал;
Е – характеристическая энергия адсорбции.
Отношение характеристических энергий для двух адсорбатов также равно ![]() . Показатель степени n выражается целыми числами от 1 до 6 в зависимости от структуры адсорбента. Степень заполнения адсорбента можно представить как отношение А/А 0 (величины адсорбции к максимальной адсорбции) или как отношение заполненного объема V к предельному объему адсорбционного пространства V 0 , тогда
. Показатель степени n выражается целыми числами от 1 до 6 в зависимости от структуры адсорбента. Степень заполнения адсорбента можно представить как отношение А/А 0 (величины адсорбции к максимальной адсорбции) или как отношение заполненного объема V к предельному объему адсорбционного пространства V 0 , тогда
A=A 0 exp[-( e/E)n ] | - общие уравнения теории объемного заполнения микропор. |
В логарифмическом виде они имеют линейную форму:
![]() .
.
Адсорбционные равновесия
Адсорбционное равновесие в системе "газ – жидкость". Закон Генри. Мономолекулярная адсорбция в системах "газ – жидкость", "жидкость – жидкость", "газ – твердое". Изотерма адсорбции Ленгмюра. Уравнение Фрейндлиха. Теория полимолекулярной адсорбции БЭТ. Уравнение БЭТ
Предположим, что имеются компоненты-неэлектролиты. Будем считать, что адсорбат образует на поверхности адсорбента мономолекулярный слой. Мономолекулярная адсорбция с точки зрения термодинамики процесса выражается химическим потенциалом в адсорбционном слое и объемной фазе:
![]() ;
;
![]() ;
;
![]() ,
,
где ![]() - химический потенциал вещества в адсорбционном слое;
- химический потенциал вещества в адсорбционном слое;
![]() - химический потенциал вещества в объемной фазе.
- химический потенциал вещества в объемной фазе.
При равновесии потенциалы равны: ![]() .
.
Преобразуем:
![]() ;
; ![]() – адсорбция; а i = c .
– адсорбция; а i = c .
![]() ,
,
![]() , где D - коэффициент распределения.
, где D - коэффициент распределения.
Выражение 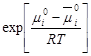 - константа Генри. Она не зависит от концентрации, определяется при постоянной температуре, A / a = K г ,
- константа Генри. Она не зависит от концентрации, определяется при постоянной температуре, A / a = K г ,
А=а × Кг – закон Генри, т.е. при разбавлении системы коэффициент распределения стремится к постоянному значению, равному константе Генри. Если концентрация в сорбционном слое стремится к нулю, то а » с ; а = × с ; - 1 . Поэтому на практике закон Генри используют в следующем виде: а=Кг с i . Если одна из фаз – газ, то имеем следующий вид: a = Кг Р i ,
Кг = Кг / RT .