Реферат: Бионеорганическая химия
БИОНЕОРГАНИЧЕСКАЯ ХИМИЯ
Введение
Бионеорганическая химия - одно из самых новых направлений неорганической химии. Задачей бионеорганической химии являются выявление неорганических соединений, участвующих в различного рода биологических процессах, их изучение, математическое и химическое моделирование биологических систем с участием этих соединений и, наконец, управление этими системами и их оптимизация. В курсе неорганической химии при систематическом рассмотрении свойств элементов периодической системы необходимо наряду с другими аспектами останавливаться и на проблемах бионеорганической химии, в том числе отмечать биологическую роль тех или иных неорганических соединений.
1. Бионеметаллы и биометаллы
В биологических процессах участвует большое число химических соединений, образованных различными элементами периодической системы. Организмы животных и растений состоят из сложных веществ, включающих в свой состав как элементы-неметаллы, так и элементы с металлическими свойствами. Из неметаллов особенно важную роль играют углерод, водород, кислород, азот, фосфор, сера, галогены. Из металлов в состав животных и растительных организмов входят натрий, калий, кальций, магний, железо, цинк, кобальт, медь, марганец, молибден и некоторые другие.
Для того чтобы оценить соотношение количеств химических элементов, входящих в состав живых организмов, полезно рассмотреть содержание биоэлементов в организме «среднего» здорового человека (вес 70 кг). Установлено, что на 70 кг массы человека приходится 45,5 кг кислорода (т. е. больше половины массы), углерода-12,6, водорода - 7,0, азота - 2,1 кг, примерно столько же фосфора. Кальция в человеке 1,7 кг, калия - 0,25, натрия - 0,07 кг, магния - 42 г, железа - только 5 г (химики шутят, что железа в человеке хватит лишь на один гвоздь), цинка - 3 г. Остальных металлов в сумме меньше, чем 1 г. В частности, меди - 0,2 г, марганца - 0,02 г.

Интересно, что вхождение химических элементов в состав живых организмов не зависит каким-либо простым образом от их распространенности. Действительно, хотя наиболее распространенный на земле элемент - кислород - является важнейшей составной частью соединений, слагающих растительные и животные организмы, такие распространенные элементы, как кремний и алюминий, в их состав не входят, а относительно мало распространенные кобальт, медь и молибден выполняют важную биологическую роль. Следует отметить также, что среди биоэлементов, т. е. элементов, играющих важную роль в построении живого организма и в процессах поддержания его жизни (обмен веществ, метаболизм), находятся очень сильно различающиеся по своим химическим свойствам, размерам частиц и электронному строению металлы и неметаллы. Например, среди биометаллов (их часто называют «металлами жизни») есть элементы, образующие ионы с благородногазовой электронной «подкладкой», несклонные к проявлению переменной валентности (Na+, K+ , Mg2+ , Са2+ ). Наряду с этим есть среди биометаллов и элементы с 18-электронной (Zn2 +) или недостроенной 18-электронной «подкладкой» (Cu2+ , Co2+ , Fe2+ , Fe3+ , Mo(V), Mo(VI)). Последние склонны изменять степень окисления в ходе обмена веществ.
Среди перечисленных биометаллов есть элементы, образующие преимущественно ионные (Na, К) и ковалентные связи (Mo, Zn); сильные комплексообразователи, такие, как Fe3+ , Co2+ , Cu2+ , Zn2+ . Однако и менее прочные комплексы, образованные, например, ионами Са2+ , Mg2+ , Mn2+ , играют важную биологическую роль, и даже ионы щелочных металлов (Na+ , К + ) в метаболических процессах вовлекаются в образование комплексов (с участием макроциклических лигандов). Установлено, что большое значение имеют размеры ионов металлов, участвующих в процессах метаболизма.
Так, например, не очень большая разница в величинах ионных радиусов Na+ (0,98 А) и К+ (1,33 А) обусловливает очень большую разницу в радиусах гидратированных ионов. Это приводит к неодинаковой роли ионов Na+ и К+ в процессе метаболизма: Na+ - внеклеточный, а К+ -внутриклеточный ионы. Именно размеры ионов, а также характерный для данного иона тип химической связи определяют, на какие ионы может замещаться тот или иной ион в процессе метаболизма. Установлено, что ионы К+ могут замещаться в живых тканях на крупные однозарядные катионы щелочных металлов (Rb+ , Cs+ ), а также на сходные по размерам ионы NH4 + и Т1+ . Напротив, относительно маленький ион Na+ может замещаться только на Li+. Интересно, что обмен на ионы Cu+ не происходит, видимо, из-за склонности Cu+ к образованию ковалентных связей, хотя размеры Cu+ и Na+ сходны.
Очень важно, что ионы Mg2+ и Са2+ в биосистемах не замещают друг друга. Это связано, как полагают, с большей ковалентностью связи Mg2+ с лигандами по сравнению с Са2+ . Еще более ковалентные связи с лигандами образует Zn2+ , он не замещается на Mg2+ , хотя близок к нему по величине ионного радиуса.
Согласно. К. Б. Яцимирскому, оценку ионности и ковалентности связей ионов биометаллов с лигандами целесообразно проводить следующим образом. Ионность связи пропорциональна отношению квадрата заряда иона к величине ионного радиуса. Это отношение для большинства ионов находится в пределах от 1 до 5. Только для бериллия это отношение аномально велико и составляет 11,7. Именно с этим связывают высокую токсичность иона Ве2+ .
Ковалентность связи металл-лиганд, по Яцимирскому, можно оценить как отношение
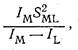
где Iм и Il - потенциалы ионизации (валентных состояний) металла и лиганда соответственно; Sml - интеграл перекрывания орбиталей, взаимодействующих при образовании ковалентной связи. Ковалентность биометаллов, охарактеризованная таким способом, обычно изменяется в интервале 20-135. При малой ковалентности связи наиболее устойчивыми оказываются соединения ионов металлов с кислородом. По мере роста ковалентности все более устойчивыми оказываются соединения со связью металл-азот и, особенно, со связью металл-сера. Такую же корреляцию дает классификация Пирсона, согласно которой «жесткая» кислота соединяется с «жестким» основанием,, а «мягкая» кислота - с «мягким» основанием.
Бионеорганическая химия рассматривает не только те элементы и их соединения, которые присутствуют в нормально функционирующем живом организме, но и те элементы (и их соединения), которые, не являясь составной частью здорового организма, могут оказывать на него то или иное воздействие, попадая в организм извне. Речь идет о взаимодействии живого организма с ядовитыми веществами, попавшими в организм случайно или накопившимися в нем, например, в результате неправильной работы тех или иных органов (производные свинца, кадмия, ртути и др.).
Надо учитывать, что очень важной является дозировка различных элементов и их соединений в живом организме. Доказано, что один и тот же элемент может положительно влиять на организм в целом и одновременно быть сильным ядом в случае его передозировки. Уже упоминалось, что цинк принадлежит к числу важнейших биометаллов: ионы Zn2+ входят в состав нескольких десятков ферментов, катализирующих протекание жизненно важных процессов. В то же время установлено, что при слишком высоком содержании Zn2+ в тканях он оказывает канцерогенное действие.
Примером того же типа может быть селен, который, вообще говоря, не причисляют к биометаллам. Однако в последнее время установлено, что уменьшение содержания селена в пище, потребляемой человеком за день, с 0,3-0,5 мг (Япония) до 0,1-0,2 мг (США, ФРГ) приводит к резкому возрастанию числа раковых заболеваний грудной железы у женщин (более чем в 5 раз). Полагают, что низкое содержание селена в пищевых продуктах, вырабатываемых в странах с высокоразвитой химической промышленностью, связано с большим содержанием в атмосфере соединений серы, вытесняющих селен из природных объектов. В Японии нехватка селена в пище меньше, так как многие пищевые продукты, извлекаемые из моря, содержат большое количество селена.
В задачи бионеорганической химии входит изучение строения и биологической роли неорганических соединений. Эти исследования проводят различными физико-химическими методами, а также методами биологии и биохимии, включающими и математическое моделирование. Бионеорганические исследования имеют первостепенную важность для решения задач медицины, охраны окружающей среды, неорганической технологии. Далее мы кратко рассмотрим свойства и строение некоторых лигандов, играющих важнейшую роль в биологии, в частности соединения, закомплексовывающие биометаллы, а затем перейдем к характеристике свойств важнейших бионеорганических соединений и их роли в процессах жизнедеятельности животных и растений.
2. Важнейшие биолиганды
Биолиганды - это молекулы или ионы, взаимодействующие в организме с биометаллами. Многие из них называются «молекулами жизни». К числу биолигандов относятся главным образом органические соединения. Однако и неорганические лиганды, хотя их существенно меньше, играют в процессах метаболизма важную и незаменимую роль. Это неорганические анионы, такие, как галогенид-ионы (F- , С1- , I- ), сульфат - и нитрат-ионы, а также гидроксил-, фосфат - и карбонат-ионы, образование и гидролиз которых вносят немалый вклад в энергетическую «копилку» живого организма. Это, наконец, нейтральные молекулы Н2 О, О2 , СО2 , NH3 . Без этих лигандов метаболизм, питание и сама жизнь организма невозможны.
Поэтому исследование взаимодействия с упомянутыми неорганическими веществами ионов биометаллов, а также других катионов, попадающих в организм извне, - важнейшая задача биохимии. Взаимодействия, реализующиеся в биосистемах, не являются специфическими и рассматриваются в рамках обычных курсов неорганической химии. Поэтому ниже будут представлены сведения лишь о лигандах, характерных именно для биосистем или моделирующих эти системы.
Комплексы с полидентатными и макроциклическими лигандами
Основной особенностью биолигандов является их принадлежность к числу полидентатных и (очень часто) макроциклических лигандов.
Как известно, особая устойчивость комплексных соединений, образованных ионами металла с полидентатными лигандами, объясняется образованием одной молекулой (или ионом) лиганда с данным центральным ионом (катионом металла) одного или нескольких хелатных циклов. Согласно правилу Чугаева, наиболее устойчивыми являются пятичленные хелатные циклы (для систем без кратных связей) и шестичленные циклы (для систем с сопряженными двойными связями). Напомним, что энергетическая выгодность замыкания хелатных циклов (хелатный эффект) определяется как энтропийным, так и эн-тальпийным факторами. Рассмотрим в качестве примера комплексообразование Ni2+ с аммиаком и этилендиамином еп:
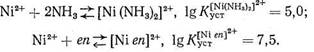 |
В обоих комплексах ион Ni2+ координирует два атома азота. Большая величина Kуст в случае этилендиаминового комплекса, несомненно, связана с хелатным эффектом: в комплексе [Niеn]2+ имеется пятичленный хелатный цикл, тогда как у комплекса [Ni (NH3 )2]2+ - «открытое» строение:
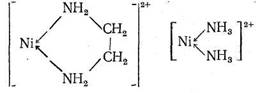 |
Координационно насыщенные аммиакаты Ni2 + имеют состав [Ni(NH3 )4]2+ или [Ni(NH3 )6]2+ .
Установлено, что разница в величинах констант устойчивости этих двух комплексов (AlgKуст = 2,5) определяется энтальпийным (∆H= - 1,9 ккал/моль) и энтропийным вкладом (∆S = 6,2 кал/град*моль). Разницу в величинах энтальпии образования этих соединений объясняют тем, что в случае [Nien]2+ двум атомам азота, входящим в координационную сферу Ni2+ , не нужно преодолевать взаимного отталкиваия (в отличие от комплекса [Ni (NH3 )2]2+ ). Атомы азота этилендиамина уже включены в состав одной молекулы («сближены» друг с другом). Кроме того, при образовании [Niеn]2+ меньше энергии требуется для дегидратации лиганда, чем в случае [Ni (NH3 )2]2+ : молекулы аммиака меньше по размеру, чем еп, они сильнее гидратируются.
Разница в величинах энтропийных факторов при образовании хелатного и «открытого» комплексов обусловлена увеличением числа частиц при протекании реакции тогда как при синтезе в водном
![]()
растворе диаммиаката никеля (II) в результате комплексообразования число частиц не меняется:
что связано с бидентатностью еп и монодентатностью NH3 .
--> ЧИТАТЬ ПОЛНОСТЬЮ <--