Реферат: Дискриминация гипотез по кинетическим экспериментам
![]() . (17)
. (17)
Квадрат по концентрации CuCl2 в числителе уравнений (16) и (17) свидетельствует о последовательном участии двух молекул CuCl2 в стадиях окисления Х1 до ДХЭ и ВДХ
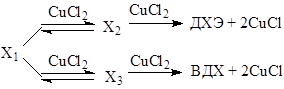 (18)
(18)
При этом стадия образования Х2 квазиравновесна (16), а стадия образования Х3 – нет (17). Чтобы найти выражение для RВХ, RДХЭ и RВДХ не хватает еще одного уравнения. Воспользуемся зависимостью (11). Эксперимент показал, что выполняется линейное соотношение (11) в форме уравнения (19) при варьировании [CuCl2]
![]() (19)
(19)
Решение системы (16), (17) и (19) дает уравнения (при [H3O+] = const)
![]() (20)
(20)
![]() (21)
(21)
![]() (22)
(22)
![]() (23)
(23)
Уравнения (20 – 23) описывают экспериментальные зависимости Rp = f([CuCl2]) и соотношение скоростей Rp.
Исследования различных модельных реакций и отклонение других гипотез образования ВДХ, например, через ClCºCH

позволило предложить механизм с участием s-металлоорганических соединений Cu(I) и Cu(II)

Образование X12 квазиравновесно. Предположительно, X12 – комплекс [CuIICl2·CuICH=CHCl « ClCuI·ClCuIICH=CHCl]. Реакция X12 c CuCl2 дает CuIICl2·ClIICuCH=CHCl, быстро распадающийся до ClCH=CHCl и 3CuCl. Превращение X12 « X13 с последующим действием второй молекулы CuCl2 приводит к ВДХ. Например, образование h2-винильного комплекса из X12 с последующим превращением его в карбеновый комплекс, распадающийся до CuI и CH2=CCl2

Рассмотренный пример показывает, насколько полезно создание искусственных разветвлений, искусственных узлов сопряжения при изучении каталитических реакций, например, реакции (12). Введение CuCl2 позволило получить дополнительную информацию о природе Х1.
На завершающем этапе выбора модели решается обратная задача химической кинетики.