Реферат: Електронні переходи і оболонки
1. Характеристика окремих електронів у молекулі і молекулярні електронні оболонки
2. Коливна структура електронно-коливного переходу. Принцип Френке-Кондора
3. Загальна характеристика обертової структури електронно-коливних смуг
4. Правила відбору і типи електронних переходів
1. Характеристика окремих електронів у молекулі і молекулярні електронні оболонки
Розглянемо характеристики станів електронів в двохатомній молекулі (одноелектронних станів) і молекулярні електронні оболонки, в які групуються окремі електрони.
Спочатку розглянемо характеристики одноелектронних станів у молекулі незалежно від властивостей атомів, що її утворюють.
Важливою характеристикою стану окремого електрона в атомі є азимутальне квантове число l, що визначає значення орбітального моменту цього електрона. В залежності від значення l ми можемо розрізняти s-, p-, d-, f-електрони і одержувати оболонки, які заповнюються 2, 6, 10, 14 ... електронами.
В двохатомній або лінійній багатоатомній молекулі можна аналогічно наближено вважати, що окремий електрон рухається в полі ядер, що утворюють вісь молекули і інших електронів. В зв’язку з цим, основною наближеною характеристикою одноелектронних станів служить квантове число l, що визначає абсолютну величину проекції орбітального моменту електрона на вісь молекули. Так як величина цієї проекції рівна l2 = m2 , де ml = 0; ±1; ±2 .., то l приймає значення l = |ml | = 0, 1, 2, 3... . Енергія електрона в молекулі залежить лише від абсолютної величини проекції, так як на електрон в молекулі діє електричне поле.
Стани з l = 0, 1, 2, 3... по аналогії з l = 0, 1, 2, 3... для атомів позначають грецькими буквами:
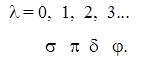
Згідно принципу Паулі, в молекулі не може бути двох електронів в одинакових квантових станах, відповідно, і з одинаковими наборами квантових чисел. Еквівалентні s-електрони (l = 0) можуть відрізнятися лише величиною ms проекції спіна на вісь молекули, яке приймає значення ms =![]() і ms = –
і ms = –![]() і ми одержимо молекулярну оболонку s2 , заповнену двома електронами. Еквівалентні p і d електрони можуть відрізнятися знаком проекції орбітального моменту і знаком проекції спіна на вісь молекули, тобто існують чотири різних стани: ml = l, ms =
і ми одержимо молекулярну оболонку s2 , заповнену двома електронами. Еквівалентні p і d електрони можуть відрізнятися знаком проекції орбітального моменту і знаком проекції спіна на вісь молекули, тобто існують чотири різних стани: ml = l, ms =![]() ; ml = l, ms = –
; ml = l, ms = –![]() ; ml = –l, ms =
; ml = –l, ms =![]() ; ml = –l, ms = –
; ml = –l, ms = –![]() і одержуються молекулярні оболонки p4 , d4 .., заповнені чотирма електронами кожна. Таким чином, в лінійних молекулах не може бути більше чотирьох еквівалентних електронів, тобто не існує молекулярних електронних оболонок, заповнених більше, ніж чотирма електронами. При цьому s-оболонки (l = 0) заповнюються двома електронами, а p- і d-оболонки (l > 0) – чотирма електронами. При інших однакових умовах енергія s-електронів менша за енергію p-електронів, а p- – менша за енергію d-електронів. Для лінійних молекул, що мають центр симетрії, одноелектронні стани можна, як і стани всієї молекули в цілому, розділити на парні g і непарні u. Таким чином, ми одержимо стани sg , pg , dg , jg … su , pu , du , ju і відповідно можемо говорити про парні і непарні електрони, що відповідає переходам з рівня v² = 0. Це пояснюється тим, що при кімнатній температурі майже всі молекули знаходяться на нижньому коливному рівні. Вигляд спектра випромінювання (люмінісценсії) залежить від характеру збудження. Якщо молекула збудження лише до деякого конкретного рівня v¢, то саме з нього і будуть здійснюватись переходи з випромінюванням, тобто виникає відповідна поперечна серія Деландра.
і одержуються молекулярні оболонки p4 , d4 .., заповнені чотирма електронами кожна. Таким чином, в лінійних молекулах не може бути більше чотирьох еквівалентних електронів, тобто не існує молекулярних електронних оболонок, заповнених більше, ніж чотирма електронами. При цьому s-оболонки (l = 0) заповнюються двома електронами, а p- і d-оболонки (l > 0) – чотирма електронами. При інших однакових умовах енергія s-електронів менша за енергію p-електронів, а p- – менша за енергію d-електронів. Для лінійних молекул, що мають центр симетрії, одноелектронні стани можна, як і стани всієї молекули в цілому, розділити на парні g і непарні u. Таким чином, ми одержимо стани sg , pg , dg , jg … su , pu , du , ju і відповідно можемо говорити про парні і непарні електрони, що відповідає переходам з рівня v² = 0. Це пояснюється тим, що при кімнатній температурі майже всі молекули знаходяться на нижньому коливному рівні. Вигляд спектра випромінювання (люмінісценсії) залежить від характеру збудження. Якщо молекула збудження лише до деякого конкретного рівня v¢, то саме з нього і будуть здійснюватись переходи з випромінюванням, тобто виникає відповідна поперечна серія Деландра.
Загальний характер розподілу інтенсивностей в системі електронно-коливних смуг визначають, виходячи з принципу Франка-Кондона. Суть принципа полягає в слідуючому. Якщо параметри потенціальних кривих, між якими проходять електронно-коливні переходи, задані, то виникає питання, які з вказаних переходів будуть більш, а які менш імовірні. Відповідь на ці питання дає принцип Франка-Кондона, зміст якого полягає в слідуючому.
Молекула, на відміну від атома, складається з двох зв’язаних підсистем, рух яких проходить з суттєво різними швидкостями. Це сукупність електронів, яка є швидкою підсистемою, і сукупність ядер, яка є повільною підсистемою. При взаємодії молекули із світлом стан швидкої підсистеми змінюється надзвичайно швидко. В той же час коливання ядер проходить значно повільніше, зміна властивостей електронної оболонки при опроміненні здійснюється так швидко, що швидкості і положення ядер при цьому змінитися не встигають. Іншими словами, в процесі електронно-коливних переходів молекула виявляється у збудженому стані при тому ж значенні міжядерної віддалі, що і в основному стані. Звідси випливає, що на діаграмах кривих потенціальної енергії квантові переходи між різними електронними станами двохатомної молекули повинні зображуватись переважно вертикальними стрілками, які відповідають умові незмінності міжядерної віддалі в процесі переходу. Таким чином, найбільш імовірними будуть переходи, що відповідають збереженню віддалі між ядрами, тобто вертикальним лініям на графіку потенціальних кривих (мал. ). На мал. приведена схема коливних переходів випромінювання (а) і поглинання (б) в рамках електронного перехода.
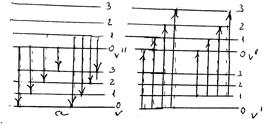
Мал. . Коливні переходи з випромінюванням (а) і поглинанням (б) в рамках одного електронного переходу.
Таку схему рівнів називають схемою Деландра. Серія ліній, що відповідає випромінюванню, називають поперечною серією Деландра, а поглинання – поздовжньою серією Деландра. Відповідно, в електронному спектрі поглинання або люмінісценсії повинно спостерігатись велика кількість смуг, що відповідають одному електронному переходу, але різним коливним переходам. Реальний спектр молекули виглядає простіше. В дійсності в поглинанні зазвичай є тільки одна поздовжня серія Деландра.
2. Коливна структура електронно-коливного переходу. Принцип Френке-Кондора
При переході між двома електронними станами, як правило, одночасно змінюються і коливна, і обертова енергія. Повна зміна енергії при переході
DЕ = DЕел + DЕкол + DЕоберт ,
Причому
DЕел > DЕкол > DЕоберт .
Кожен електронний перехід між двома електронними термами (станами) характеризується певною коливною структурою, яка складається з сукупності смуг, а кожна смуга характеризується певною обертовою структурою, яка предятавляє собою сукупність окремих ліній.
Розглянемо спочатку коливну структуру, яка, на противагу обертовій, не залежить беспосередньо від властивостей симетрії комбінуючих електронних станів і визначається видом кривих потенціальної енергії для цих станів. Положення смуг коливної структури визначається різницею DЕкол = DЕ¢кол – DЕ²кол енергії коливань DЕ¢кол для верхнього електронного рівня і енергії коливань DЕ²кол для нижього електронного рівня, які, якщо обмежитися двохчленною формулою, рівні:
DЕ¢кол = n¢е![]() – х¢е n¢е
– х¢е n¢е![]() ;
;
DЕ²кол = n²е![]() – х²е n²е
– х²е n²е![]() .
.
Значення постійних nе і хе , тобто частот коливань і коефіцієнтів, які визначаються ангармонічністю, для різних електронних станів в загальному різні. Як правило, для збудженого стану міцність зв’язку менша, а рівноважна віддаль між ядрами більша, ніж для основного стану, і крива потенціальної енергії проходить більш полого. В результаті частота коливань nе у збудженому стані менша, ніж у нормальному, а із збільшенням збудження вона зменшується. Тому n²е > n¢е відповідно і віддалі між коливними рівнями для верхніх електронних станів менші, ніж для нижніх станів. Наприклад, для основного електронного стану 1 S+ молекули СО n²е = 2169 см–1 , а для збудженого стану n¢е = 1515 см–1 .
Частота nе беспосередньо зв’язана з силовою постійною (K) молекули в даному електронному стані. Зменшення nе при збудженні молекули означає зменшення силової постійної, яка проходить, як правило, одночасно із зменшенням міцності зв’язку, тобто енергії дисоціації.

Вертикаль проводиться з центра рівня v² = 0, тобто з мінімума потенціальної кривої, так як для v² = 0 найбільш імовірне утворення молекули відповідає r = re .
Можливі три основні випадки розподілу інтенсивностей в серії Деландре v² = 0:
--> ЧИТАТЬ ПОЛНОСТЬЮ <--