Реферат: Електронні переходи і оболонки
Мал. Парабола Кондона: * – відмічені найбільш імовірні переходи
3. Загальна характеристика обертової структури електронно-коливних смуг
Обертова структура електронно-коливних смуг визначається зміною обертової енергії при відповідному переході DЕоберт = DЕ¢оберт + DЕ²оберт . Для обертових рівнів верхнього електронно-коливного стану маємо: DЕ¢оберт = ![]() hy¢(y¢ + 1) і для обертових рівнів нижнього електронно-коливного стану маємо аналогічно: DЕ²оберт =
hy¢(y¢ + 1) і для обертових рівнів нижнього електронно-коливного стану маємо аналогічно: DЕ²оберт = ![]() hy²(y² + 1). Таким чином, без врахування поправок на центробіжне розтягування молекули одержимо: DЕоберт = =
hy²(y² + 1). Таким чином, без врахування поправок на центробіжне розтягування молекули одержимо: DЕоберт = = ![]() hy¢(y¢ + 1) –
hy¢(y¢ + 1) – ![]() hy²(y² + 1). Обертові постійні для верхнього і нижнього стану різні і лише в деяких випадках приблизно співпадають. Їх основна відмінність визначається зміною рівноважної віддалі rе між ядрами при переході молекули з одного електронного стану в інший. Як уже вказувалося, при електронному збудженні молекули Еел збільшується; це приводить до збільшення моменту інерції і до зменшення обертової постійної. Тому В¢ < В².
hy²(y² + 1). Обертові постійні для верхнього і нижнього стану різні і лише в деяких випадках приблизно співпадають. Їх основна відмінність визначається зміною рівноважної віддалі rе між ядрами при переході молекули з одного електронного стану в інший. Як уже вказувалося, при електронному збудженні молекули Еел збільшується; це приводить до збільшення моменту інерції і до зменшення обертової постійної. Тому В¢ < В².
При електронних переходах в загальному випадку для обертового квантового числа у має місце звичайне правило відбору для моментів кількості руху: Dу = 0; ±1. Для зміни обертової енергії при електронно-коливних переходах можна використати всі формули, виведені для зміни обертової енергії при чисто коливних переходах. Ми маємо R-, P- і Q-гілки:
nR = n0 + 2B¢v + (3B¢v – B²v ) j + (3B¢v – B²v ) j2 ;
nP = n0 – (2B¢v + B²v ) j + (B¢v – B²v ) j2 ;
nQ = n0 + (B¢v – B²v ) j + (B¢v – B²v ) j2 .
Відповідні R-, P- і Q-переходи показані на малюнку .
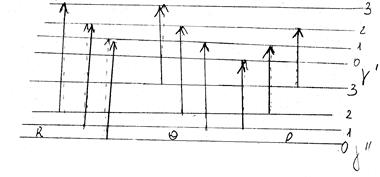
Мал. . R-, P- і Q-гілки обертових переходів в електронно-коливних спектрах Dj = +1(R);
Dj = +1(R); Dj = 1(Q); Dj = –1(P).
Якщо ввести к формули ціле число m, де
m = j¢ для R-гілки m = 1, 2, 3..,
m = –j² для P-гілки m = –1, –2, –3..,
m = j¢ = j² для Q-гілки m = 1, 2, 3..,
то формули приймуть вигляд:
R- і P-гілки: DЕ = n0 + (В¢ + В²) m + (В¢ – В²) m2 ;
Q-гілка: DЕ = n0 + (В¢ – В²) m (m + 1).
Тут n0 – частота електронно-коливного переходу, що відповідає m = 0.
4. Правила відбору і типи електронних переходів
Основні типи електронних переходів в двохатомних молекулах визначаються правилами відбору, як загальними, так і більш окремими. Перш за все, для повного моменту кількості руху молекули справедливе загальне правило відбору Dj = 0, ±1 (з додатково забороненим переходом j¢ = 0 ® j² = 0.
У відповідності з поділом станів молекули на додатні і від’ємні є правило відбору, що дозволяє переходи між станами одинакової симетрії + « –. Для молекул, що мають центр симетрії, парні електронні стани комбінують з непарними g « u. Важливою характеристикою електронних станів молекули є квантове число L, що визначає величину проекції орбітального моменту кількості руху на вісь молекули і рівне абсолютному значенню цієї проекції. Для L має місце правило відбору: DL = 0, ±1. Таким чином, можливі переходи S–S, S–P, P–P, P–D, D–D. Ці переходи можна розділити на три типи:
1 тип – переходи S–S, DL = 0, L = 0;
2 тип – переходи S–P, P–D, DL = 1;
3 тип – переходи P–P, D–D, DL = 0 і DL ¹ 0.
Відмітимо, що при позначенні електронних переходів спочатку записують символ верхнього стану, а потім нижнього і, відповідно, перехід записується L¢–L². Наприклад, S–P означає перехід між верхнім станом S і нижнім P-станом.
Для переходів першого типу є додаткове обмеження, зв’язане з тим, що S-стани можуть бути додатніми (S+ ) і від’ємними (S– ). Дозволені переходи лише між S-станами одної симетрії: S+ –S+ ; S– –S– .
Переходи трьох типів відрізняються своєю обертовою структурою. Для переходів першого типу S–S є додаткове правило відбору, яке забороняє Q-гілку і виникають тільки R- і Р-гілки. Для переходів другого типу, зокрема S–P і P–S проявляються всі три гілки R, P і Q. Для переходів третього типу, зокрема P–P, також можливі всі три гілки, але в Q-гілці інтенсивність різко зменшується із збільшенням квантового числа і ця гілка слаба.
При участі спіна одержується подальша класифікація типів електронних переходів. Як і для атомів, є наближене правило відбору для повного спінового механічного моменту S, DS = 0. Найбільш простою є обертова структура переходів 1 S± – 1 S± . Для них одержуються R- і Р-гілки (Q-гілка відсутня).
Суцільні спектри поглинання і випромінювання двохатомної молекули. Поряд з дискретними спектрами для лінійних молекул можуть виникати і суцільні спектри. Вони утворюються при переходах між двома станами, по крайній мірі один з яких відповідає неперервній послідовності значень енергії.