Реферат: Етіологія топічна діагностика та лікування інфекцій сечової системи
n=223
ХНЦ (IV)
n=80
Вік, роки
34,1±3,97
33,8±4,1
33,6±4,97
32,9±5,0
kKU=0,5 р=0,48
Тривалість захворювання, роки
0,7±0,3
14,06±2,57
16,5±2,36
13,2±4,6
kKU=3,1* р=0,08
Примітка. * – тривалість захворювання пацієнтів I групи не порівнювали
Рецидивуючий перебіг захворювання констатовано у 328 (68,0%) хворих на ХІСС, серед яких 101 (65,0%) пацієнтка II групи, 169 (76,0 %) – III та 58 (72,5%) – IV. Кількість рецидивів у жінок з ХУПН була достовірно більшою, ніж у хворих на ХНПН (c2 =3,16, р=0,02).
Усім хворим проводилось загальноклінічне (опитування, фізикальне обстеження), клінічне лабораторне (аналізи крові та сечі), біохімічне (рівні загального білка і його фракцій, креатиніну, сечовини, електролітів, білірубіну, АлТ, АсТ у сироватці крові) та ультразвукове дослідження органів черевної порожнини і сечового міхура; вивчали рівень β2 -мікроглобулінурії та добової протеїнурії, підраховували ШКФ (за формулою Cockroft-Gault). В роботі використовували гематологічний аналізатор «ABX Micros-60» (Франція) та біохімічні аналізатори «Flexor junior» (Нідерланди) і «PR2100-Sanofi» (Франція).
Топічний діагноз формулювали керуючись наступними дефініціями: гострий пієлонефрит – перший епізод бактеріально-обумовленого ураження інтерстицію нирки; хронічний пієлонефрит – інфекційно-індуковане вогнищеве запалення інтерстицію нирок з формуванням рубців і наступним ураженням усіх структур нефрона; цистит – гострий або хронічний запальний процес слизового шару сечового міхура або слизового, підслизового та м’язового шарів відповідно. За неускладнену ІСС вважали інфекцію у здорової, сексуально активної, невагітної жінки віком від 16 до 65 років, яка не супроводжувалась лихоманкою. ІСС у жінок у постменопаузальному періоді або з наявністю супутніх захворювань та/або анатомічних чи функціональних порушень визначали як ускладнену. Рецидивуючий перебіг ІСС встановлювали за умов 2 рецидивів захворювання впродовж півроку або 3 рецидивів за рік.
Мікробіологічне обстеження включало визначення у сечі, зішкрябах зі слизових оболонок цервікального каналу, уретри та піхви бактерій, грибів молікутів і хламідій. У сироватці крові за допомогою імуноферментного аналізатору (ІФА) визначали рівні Ig G до ВПГ, ЦМВ, Toxoplasma gondii та C. trachomatis [Биргер М.О, 1982; Меньшиков В.В., 1987]. В роботі використовували тест-системи виробництва «Orgenics» (Ізраїль) та «Вектор-Бест» (Росія). Детекцію ДНК C. trachomatis в клінічному матеріалі проводили ампліфікаційним методом у ПЛР з використанням праймерів та обладнання виробництва фірм «ДНК-технологія» та «Амплісенс» (Росія). Молікути (M. hominis та U. urealyticum) виділяли, користуючись тест-системами Mycoplasma-DUO. Ідентифікацію виявлених бактерій проводили за Bergey’s. Чутливість бактерій до антибіотиків визначали методом стандартних дисків [Биргер М.О, 1982]. Кількісні показники мікробного навантаження в досліджуваному матеріалі визначали, враховуючи наступні градації: «вагома» бактеріурія – ≥105 колонієутворюючих одиниць в 1 мл сечі (КУО/мл) та «порогова» – 102 - 104 КУО/мл.
Для дослідження стану місцевого імунітету виконували змиви з цервікального каналу, шийки матки та уретри жінок, в яких визначали рівні sIg A, Ig А, Ig G, лактоферину, лізоциму, комплементу. Рівень s-Ig A, Ig класів A, M та G та визначали методом радіальної імунодифузії в гелі за Mancini [Mancini G., 1965]. Активність лізоциму (мурамідази) оцінювали біологічним методом з використанням препарату добової культури Mycrococcus lysodeicticus [Меньшиков В.В., 1987]. Рівень комплементу визначали за гемолітичним методом [Меньшиков В.В., 1987], лактоферину – за допомогою ІФА з використанням тест-системи виробництва НВО «Вектор-Бест» (Росія). Функціональну активність фагоцитуючих клітин (ФАФК) тестували культуральним методом. Бактерицидну активність фагоцитів (БАФК) визначали мікрометодом у НСТ-тесті [Меньшиков В.В., 1987].
Оцінку клітинної ланки імунітету проводили за допомогою моноклональних антитіл до диференційованих антигенів лімфоцитів CD3, CD4, CD8, CD19, CD22 та CD119+. Вміст Ig A, G, M визначали за Манчіні [Mancini G., 1965], імунних комплексів в сироватці – за допомогою методу преципітації поліетиленгліколем [Косицкая Л.С., 1980]. Кількість фагоцитуючих клітин та їх поглинаючу активність визначали за їх здатністю поглинати частинки латексу [Косицкая Л.С., 1980]. Вміст цитокінів та їх концентрацію у сечі визначали за допомогою ІФА; використовували тест-системи «Diaclone» (Франція) і TRG (США), аналізатор Stat Fax 303 Plus. Експресію ICAM-1 на клітинах оцінювали використовуючи флюоресціюючі моноклональні антитіла (CD54) («Медбіоспектр», Росія) та люмінесцентну мікроскопію.
Інтенсивність вільнорадикального окислення оцінювали спектрофотометрично за вмістом малонового діальдегіду (МДА) в крові та сечі [Стальная И.Д., 1987]. Концентрацію ЦП в сироватці крові визначали за реакцією з п-фенілендіаміндигідрохлоридом, ЗПА еритроцитів визначали за реакцією з індигокарміном, вміст ТР у сироватці крові за реакцією з залізо-амоній цитратом [Меньшиков В.В., 1987]. Активність ТА, НАГ та β-Гал визначали згідно з рекомендаціями А.А. Покровського [Покровский А.А., 1971].
Спільно з кафедрою радіології Національного медичного університету імені О.О. Богомольця МОЗ України 186 жінкам проведено ДРСГ з 99m Tc-MAG3, ДРСГ з 99m Tc-пірофосфатом та ДРСГ і СРСГ з 99m Tc-ДМСО. Оцінка сцинтиграм включала дані про топографію нирок, їх розміри та площу зображення, час появи зображення сечового міхура, відсоток накопичення РФП у сечовому міхурі за 30 хвилин, особливості накопичення і розподілу РФП в нирках (дифузний, вогнищевий) та наявність ділянок склерозу ниркової тканини (так званих «шрамів» або «рубців») [Кундин В.Ю., 2004].
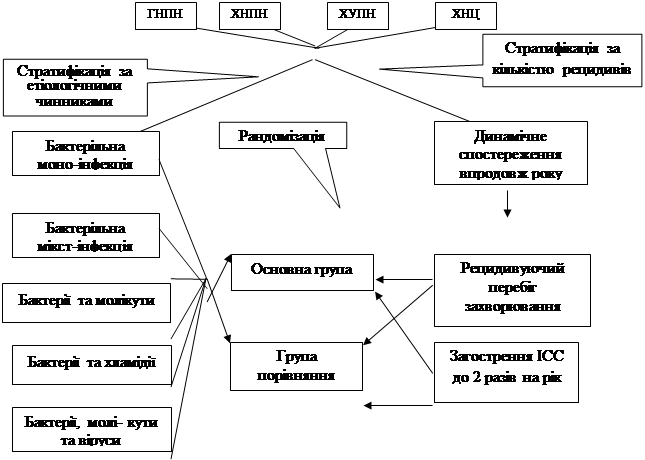
Серед обстежених жінок, за допомогою стратифікованої рандомізації, було виділено 2 групи: основну і групу порівняння. Схему, за якою було сформовано групи, наведено на рисунку 2.
Жінки основної групи отримували модифіковане лікування, яке включало антибактеріальну терапію, спрямовану як на ерадикацію збудника захворювання, так і на інфекції, що передається статевим шляхом. Крім антибіотиків у схемі лікування цієї групи хворих застосовували імунотропні препарати та Ліпін. Хворі групи порівняння отримували тільки антибактеріальну терапію.
Антибактеріальну терапію призначали згідно з чутливістю виявлених збудників та відповідно до міжнародних рекомендацій лікування ІСС [Steven E et al., 2005; Tamaki K. et al., 2006; UpToDate., 2006]. Поряд з цим, за необхідності, застосовувались протигрибкові препарати, гепатопротектори, пробіотики та гіпотензивні засоби.
Основними антибактеріальними препаратами, які використовувались для лікування хворих на ІСС, були фторхінолони (левофлоксацин, пефлоксацин, ципрофлоксацин) та цефалоспорини (цефіксим, цефтріаксон, цефоперазон) II, III генерацій, амоксицилін/клавуланат. Спосіб введення препаратів та тривалість терапії визначали залежно від топіки запалення та наявності ускладненої ІСС. Жінки основної групи, які були інфіковані молікутами та/або хламідіями, додатково отримували азітроміцин і доксициклін [Стандарты антибактериальной терапии, 2005].
| ||||||||
 | ||||||||
 | ||||||||
| ||||||||
Рис. 2. Схема формування груп хворих