Реферат: Фазовые равновесия в системе MgS-Y2S3
Для реализации на практике потенциальных возможностей новых материалов необходимо определить условия их существования и методы синтеза. Это позволяет сделать физико-химический анализ путем построения Т –Х – проекции диаграммы состояния, являющейся основанием для синтеза материалов.
Цель настоящей работы состоит в изучении фазовых равновесий в системе MgS – Y2 S3 при использовании методов физико-химического анализа.
Глава 1. Литературный обзор.
1.1. Фазовые равновесия в системе MgS-Y2 S3 .
1.1.1. Фазовое равновесие в системе Mg-S.
Моносульфид MgS имеет кубическую кристаллическую структуру типа NaCl. Структура MgS образуется сочетанием довольно объемных анионов серы и значительно меньших по размерам катионов металлов. Можно предполагать, что анионы серы как более крупные по размерам имеют тенденцию к регулярному расположению в элементарных ячейках довольно тесно один возле другого; они образуют при этом пустоты, в которых располагаются катионы. Каждый ион магния окружен шестью ионами серы, расположенными в вершинах правильных октаэдров. Все пустоты, в которых периодически располагаются катионы (согласно их размерам и заряду), в структуре MgS заняты и возможность образования твердого раствора по разрезу MgS-Ln2 S3 маловероятна.[1]. В системе Mg-S (рис.1) образуется единственная фаза MgS. Температура плавления составляет 2270К, при которой MgS разлагается.[2]

![]()
![]()
![]()
![]()
![]()
![]()
![]()
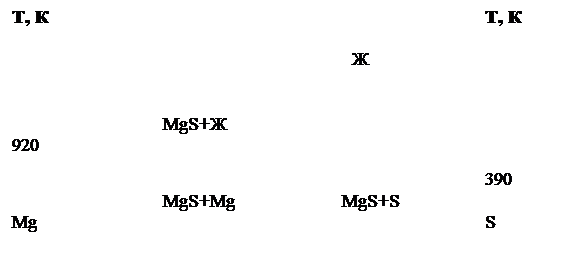 |
Рис. 1 Ориентировочная диаграмма состояния системы MgS.
Свойства MgS
MgS получают:
1. Mg+S=MgS (реакция происходит в фарфоровой трубке при 8000 С).
2. 2Mg + S + H2 S = 2MgS + H2
3. MgO + CS2 = 2MgS + CO2 (температура 700-9000 С).
4. MgO + C + S = MgS + CO
5. MgSO4 +2C = MgS + 2 CO2 (температура 9000 С).
MgS представляет собой бесцветные (или розовато-красные из-за примесей) кубические кристаллы с решеткой типа NaCl (межатомные расстояния 2,89 А) и плотностью 2,79 гр/см3 . Они плавятся при температуре 20000 С, фосфоресцируют, вызывают красное катодное свечение, трудно растворимы в воде, реагируют с холодной водой[2]:
3MgS + 2HOH = Mg (HS)2 + 2MgO + H2 S
При гидролизе MgS в теплой воде образуется окись магния и сероводород[3]:
MgS + HOH = MgO + H2 S
Разбавленные кислоты, такие как HF, HCl, H2 SO4 , реагируют с MgS, образуя соли и H2 S. Cl, Br, I энергично реагируют с нагретым выше 3000 С MgS, образуя соответствующие галогениды.
Двуокись углерода под давлением 50-100 мм.рт.ст. реагирует с MgS, нагретым выше 6600 С[4]:
MgS + CO2 = MgO + COS
1.1.2. Фазовое равновесие в системе Y-S.
Существуют следующие сульфидные фазы иттрия YS, Y5 S7 , d-Y2 S3 , γ‑Y2 S3 , YS2 .
Результаты изучения кристаллохимических характеристик и некоторых физических свойств сульфидов собраны в табл.1. Данные по диаграмме состояния системы Y-S не обнаружены.
Предложение о фазовой диаграмме состояния можно сделать на основе кристаллохимических данных, имеющихся по системе Y-S. Моносульфид YS кристаллизуется в структурном типе NaCl. На основе YS существует дефектный твердый раствор типа вычитания серы до состава YS0,75 (Y4 S3 ), при этом период решетки a уменьшается от 5,493 (YS) до 5,442 A° (Y4 S3 ).
Соединение Y5 S7 содержит две формульные единицы в элементарной ячейке. Полуторный сульфид d-Y2 S3 кристаллизуется в структурном типе моноклинного Ho2 S3 с 6 формульными единицами в ячейке. В ячейке дисульфида (полисульфида) иттрия содержится. 8 формульных единиц YS2 .
Тетрагональный YS2 существует при температуре выше 500°C в интервале давлений 15-35 кбар. Кубический же YS2 образуется в интервале давлений 35-70 кбар.
Стехиометрический дисульфид иттрия даже в условиях высоких давлений и температур (500-1200°C) не существует.
1.1.3. Кристаллохимическая характеристика фаз в системе Mg-S,Y‑S.
Табл.1 Кристаллохимические свойства сульфидов иттрия и магния .
| Формула | Цвет | Сингония | Пространственная группа | Структурный тип | Период решетки, Å | Плотность г/см3 | |||
a | b | c |
пинкном |
рентген | |||||
| MgS | Бесц. | кубическая | Fm 3m | NaCl | 5,191 | 2,79 | |||
| YS | Рубиново красный | кубическая | Fm 3m | NaCl |
5,477 5,493 5,495 | 4,51 | 4,92 | ||
| Y5 S7 | Сине-черный | моноклинная | C2 / m | Y5 S7 |
12,67 12,768 |
3,81 3,803 |
11,45 11,550 |
4,19 4,10 |
4,18 К-во Просмотров: 323
Бесплатно скачать Реферат: Фазовые равновесия в системе MgS-Y2S3
|