Реферат: Фотохимические реакции. Радиационно-химические реакции
![]() молярная доля i-го компонента (
молярная доля i-го компонента (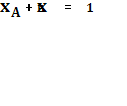 ).
).
Для исследуемых компонентов (например, A и В), если известны величины теплот плавления ![]() , уравнение Шредера - Ле-Шателье будет иметь вид
, уравнение Шредера - Ле-Шателье будет иметь вид


или

 (1.2)
(1.2)
где ![]() и
и ![]() — температуры плавления компонентов А и В, K;
— температуры плавления компонентов А и В, K;
![]() и
и ![]() — теплоты плавления компонентов А и В, кДж/(моль
— теплоты плавления компонентов А и В, кДж/(моль![]() К);
К);
 — молярная доля компонентов А и В;
— молярная доля компонентов А и В;![]()
![]() и
и ![]() — температуры ликвидуса соответственно при добавлении к компоненту А компонента В и наоборот.
— температуры ликвидуса соответственно при добавлении к компоненту А компонента В и наоборот.
По уравнению (1.2) строятся диаграммы плавкости двухкомпонентных систем, близкие к диаграммам состояния, построенным на основании экспериментальных данных.
2)Расчет кривых ликвидуса по уравнению Эпстейна - Хоуленда.
При отсутствии значений используется допущение Эпстейна - Хоуленда, выражающее зависимость между энтропией плавления соединения и числом атомов в молекуле:
 (1.3)
(1.3)
![]() берется со знаком плюс. Подставив выражение (1.3) в формулу (1.2), получим уравнение для расчета бинарных систем:
берется со знаком плюс. Подставив выражение (1.3) в формулу (1.2), получим уравнение для расчета бинарных систем:

 (1.4)
(1.4)
где ![]() и
и ![]() — число атомов в молекулярной формуле компонентов А и В соответственно.
— число атомов в молекулярной формуле компонентов А и В соответственно.
Вычислив  для заданных значений
для заданных значений  , можно рассчитать ориентировочные значения
, можно рассчитать ориентировочные значения ![]() .
.
3)Расчет по методу С. А. Суворова.
Приближенный расчет температур ликвидуса, состава и температуры эвтектики двухкомпонентной системы можно выполнить, используя эмпирические уравнения Суворова, в основе которых лежит учет соотношений между числом атомов и молекулярной формуле обоих компонентов.
Исходными данными для расчета являются температуры плавления чистых компонентов А и В, число атомов в молекулярной формуле компонентов А и В и сумма числа атомов N, равная сумме nА и ![]() .
.
Достаточно надежные данные по составу эвтектики можно получить, используя для расчетов следующие формулы:
1) при 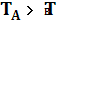 и nА <
и nА < ![]() (например, в системе MgO−Mg
(например, в системе MgO−Mg![]() ):
):
 (1.5)
(1.5)
где 
2) при 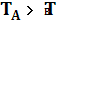 и nА >
и nА > ![]() (например, Ni
(например, Ni![]() ):
):
 (1.6)
(1.6)
3) при nА =![]() в системе из простых оксидов (например,MgO−CaO):
в системе из простых оксидов (например,MgO−CaO):
![]() (1.7)
(1.7)
4) при nА =![]() в системе из более сложных соединений (например, Mg
в системе из более сложных соединений (например, Mg![]()
 (1.8)
(1.8)
Для ориентировочных расчетов температуры эвтектики можно использовать уравнение
 ,
,
где К — отношение молярных концентраций компонентов системы в эвтектике, т.е. К = .С большим приближением температуру плавления эвтектики можно вычислить по формуле
.С большим приближением температуру плавления эвтектики можно вычислить по формуле  .
.
Вычислив  и подставив эти значения в уравнения (1.2), можно рассчитать значения
и подставив эти значения в уравнения (1.2), можно рассчитать значения
![]()