Реферат: Главные элементы жизни: азот и фосфор
Аммиак взаимодействует с перманганатом калия:
NH3 + KMnO4 = N2 + H2 O + MnO2 +KOH
Добавление аммиака изменяет цвет раствора:
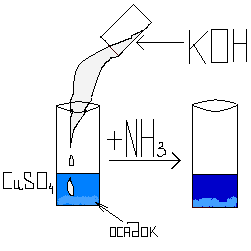
Важным химическим свойством аммиака является его взаимодействие с кислотами с образованием солей аммония . В этом случае к молекуле аммиака присоединяется ион водорода кислоты, образуя ион аммония, входящей в состав соли:
H
![]()
![]() NH3 + H+ Cl-- [H N H]Cl
NH3 + H+ Cl-- [H N H]Cl
H
Связь между ионами NH4 и Cl ионная, в ионе NH4 четыре связи ковалентные, причём три из них полярные и одна по донорно – акцепторном механизму.
Соли аммония.
Соли аммония и аниона кислоты. По строению они аналогичны соответствующим солям однозарядных ионов металлов. Соли аммония получаются пи взаимодействии аммиака или его водных растворов с кислотами. Например:
NH3 + HNO3 = NH4 NO3
NH3 . H2 O + HNO3 = NH4 NO3 + H2 O
Они проявляют общие свойства солей, т.е. взаимодействуют с растворами щелочей, кислот и других солей:
(NH4 )Cl + NaOH = NaCl + H2 O + NH3
![]() КОНЦ .
КОНЦ .
2NH4 Cl + H2 SO4 = (NH4 )2 SO4 + 2HCl
(NH4 )2 SO4 + BaCl2 = 2NH4 Cl + BaSO4
Все аммонийные соли при нагревании разлагаются или возгоняются, например:
![]()
![]() (NH4 )2 CO3 = 2NH3 + H2 O CO2
(NH4 )2 CO3 = 2NH3 + H2 O CO2
![]() NH4 NO2 = 2H2 O + N2
NH4 NO2 = 2H2 O + N2
![]()
![]() NH4 Cl NH3 + HCl
NH4 Cl NH3 + HCl
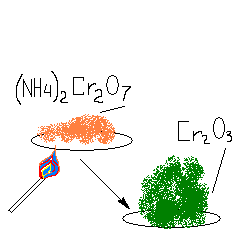
(NH4 )2 Cr2 O7 = Cr2 O3 + 4H2 O + N2
Качественная реакция на ион аммония. Очень важным свойством солей аммония является их взаимодействие с растворами щелочей. Этой реакцией обнаруживают соли аммония (ион аммония) по запаху выделяющегося аммиака или по появлению синего окрашивания влажной лакмусовой бумажки:
![]()
![]() NH4 + + OH H2 O + NH3
NH4 + + OH H2 O + NH3
Реакцию проводят так: в пробирку с испытуемой солью или раствором вводят раствор щелочи и смесь осторожно нагревают. В случае присутствия иона аммония выделятся аммиак.
Оксиды азота.
Азот образует шесть кислородных соединений, в которых проявляет степени окисления от +1 до +5: N2 +1 O, N+2 O, N2 +3 O3 , N+4 O2 , N2 +4 O4 , N2 +5 O5 . При непосредственном соединении азота с кислорода образуется только оксид азота (II) NO, другие оксиды получают косвенным путем. N2 O и NO – несолеобразующие оксиды, остальные – солеобразующие. Из всех оксидов азота наибольшее значение имеют оксиды азота (II) и азота (IV) как промежуточные продукты в производстве азотной кислоты.