Реферат: Изоморфизм уравнений диссипативных свойств растворов электролитов
R0 – радиус молекулы растворителя,
р – дипольный момент молекулы растворителя,
- диэлектрическая проницаемость среды,
Мs – молекулярная масса растворителя.
Zэ – экранированный заряд ядра находится используя константы экранирования Слейтера определяемые по стандартным правилам приводимым в различных учебниках по теоретической основе неорганической химии, в частности [9].
Таблица 1
Радиусы ионов, сольватные числа и радиусы сольватированных ионов рассчитанные по уравнениям 26 – 28
| Ион | I, эв | Zэ | ns | ||
| Li+ | 75,62 | 2,7 | 0,5446 | 7,3873 | 4,4246 |
| Na+ | 47,29 | 6,55 | 1,0004 | 3,2301 | 3,3583 |
| K+ | 31,81 | 7,75 | 1,3785 | 1,8682 | 2,7980 |
| Cl- | 3,82 | 4,875 | 1,8100 | 1,0090 | 2,2786 |
Таблица 2
Приведенные радиусы молекул рассчитанные по формуле 25
| Молекула | |
| LiCl | 1,5040 |
| NaCl | 1,3575 |
| KCl | 1,2559 |
Выражая из уравнения (17) вязкость и коэффициент диффузии через электропроводность (Т = 298К), получим отдельно для каждого i-го иона:
![]() (29)
(29)
![]() (30)
(30)
Переходя к вязкости и диффузии, как свойствам раствора, необходимо учитывать взаимную корреляцию движения ионов противоположного знака, поэтому вязкости и коэффициенты диффузии отдельных ионов одной молекулы, объединяем в приведенное значение.
Например, для 1-1 электролита
![]() (31)
(31)
![]() (32)
(32)
Соответственно при бесконечном разбавлении
![]() (33)
(33)
![]() (34)
(34)
Неренст и Хартли для определения коэффициента диффузии одного единственного электролита предложили уравнение (23)
![]() (35)
(35)
где D0 – предельное значение коэффициента диффузии по Нернсту (33)
Сравнивая теоретические уравнения электропроводности (1) и диффузии по Неренсту – Хартли (35), учтя в последнем максвеловское распределение по скоростям и параметр экранирования, можно показать, что
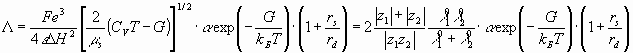 (36, 37)
(36, 37)
Электропроводности экспериментально найденные, и рассчитанные по уравнениям (36, 37), приведены в таб. 4.3 – 4.5.
Из полученных данных можно сделать вывод, что электропроводность найденная по уравнению (36) хорошо согласуется с экспериментально найденной в случаях хлоридов натрия и калия, хуже для хлорида лития, но электропроводность рассчитанная по уравнению (37) для хлорида лития практически совпадает с данными полученными по уравнению (36), в остальных случаях уравнение (37) дает небольшое расхождение с опытом.
Роль среднего значения кинетической энергии ионов в уравнении (1), которая, согласно теореме вариала, равна по модулю среднему значению полной энергии, играет функция 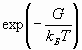 , причем
, причем 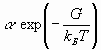 - есть максвелловское распределение по скоростям.
- есть максвелловское распределение по скоростям.
В уравнении (35) выражение ![]() равно
равно ![]() , а это есть –полная энергия молекулы при данной концентрации.
, а это есть –полная энергия молекулы при данной концентрации.
Роль распределения для коэффициента диффузии играет функция ![]() , которую, если учесть при средне молярном коэффициенте активности, можно представить в виде
, которую, если учесть при средне молярном коэффициенте активности, можно представить в виде 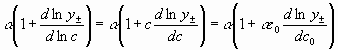 .
.