Реферат: Каталітичні процеси
Розглянемо енергетичну картину реакційної системи, наприклад, для бімолекулярної реакції
![]() ,
,
яка проходить під час відсутності каталізатора за схемою
![]()
через утворення активного комплексу АВ* . У присутності каталізатора реакція їде по іншому шляху через кілька елементарних стадій:
А + [kat] = A[kat]
A[kat] + B = AB* [kat]
AB* [kat] = R + [kat]
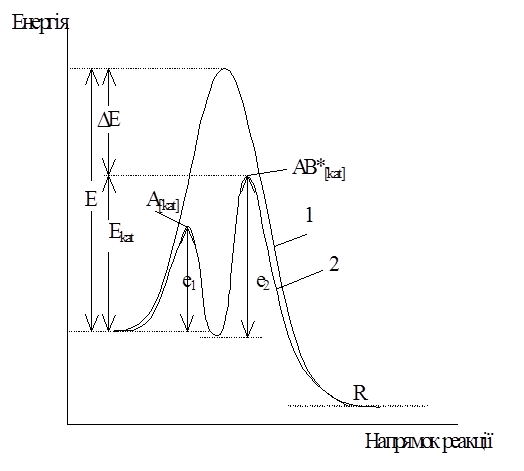
Рис.1. Зміна енергії реагуючої системи
при некаталітичній (1) і каталітичної (2) реакції:
Е – енергія активації некаталітичної реакції;
Екат – каталітичної реакції;
е1 і е2 – енергії активації проміжних стадій.
1.1 Активність каталізаторів
Найбільш важливою характеристикою каталізаторів є їхня активність, тому що міра дії каталізатора, що прискорює, стосовно даної реакції
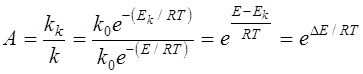
Розглянемо на прикладі окислювання сірчистого ангідриду
2SO2 + O2 = 2SO3 + Q
Енергії активації при 420о С (693 К) складає 420000 Дж/моль. На ванадієвому каталізаторі V2 O5 Ek = 268000 Дж/моль К. R = 8,3 Дж/моль К.
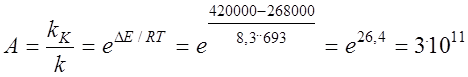
1.2 Селективність (вибірковість каталізаторів)
Вибірковість дії – найважливіша особливість каталізаторів, що визначила успіх їхнього широкого застосування в ряді галузей промисловості. Особливо важливий він у виробництві органічних продуктів, коли селективність дозволяє сильно прискорювати одну корисну реакцію, проводити процес при пониженної температурі, пригнітаючи інші реакції.
Селективність дії каталізатора Iкат можна виразити відношенням швидкості утворення цільового продукту до сумарної швидкості перетворення основної вихідної речовини.
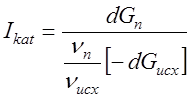 ,
,
де Gп – кількість продукту;
υп /υисх – співвідношення стехиометрических коефіцієнтів при утворенні продуктів з основної вихідної речовини.
Загальну інтегральну селективність дії каталізаторів можна виразити співвідношенням
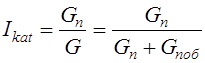 .
.