Реферат: Каталітичні процеси
Gпоб - кількість вихідної речовини, що вступили в побічні реакції;
Gп - кількість вихідної речовини, що превратились у цільовий продукт.
2.Гомогенний і гетерогенний каталіз
Гомогенні каталітичніреакції широко поширені в природі. Прикладом промислових гомогенних каталітичних процесів може служити реакція етерифікації, омилення складних ефірів і т.д.
Механізм каталітичної дії при гомогенному каталізі полягає в утворенні між реагуючими сполуками і каталізатором проміжних сполук, які у деяких випадках можливо навіть виділити. Прискорення реакції в більшості випадків проходить за рахунок зниження енергії активації. При гомогенному каталізі в розчинах каталітичну дію можуть робити іони водню, гідроксилу, солей, а також речовин, що сприяють утворенню вільних радикалів.
Каталіз під дією іонів чи водню гідроксилу називають кислотно – основним. Цей вигляд каталізу найбільш розповсюджений. Сутність його полягає в переході протона від каталізатора до реагуючої речовини (каталіз кислотами) чи від реагуючої речовини до каталізатора (каталіз підставами). Надалі протон переміщається в зворотному напрямку і каталізатор регенерується.
На швидкість гомогенних каталітичних реакцій впливають багато факторів: активність каталізатору, температура, концентрація каталізатору, перемішування.
Гетерогенний каталіз.
Основним недоліком гомогенного каталізу є труднощі виділення каталізатора з кінцевої реакційної суміші, у результаті чого частина каталізатора губиться безповоротно, продукт забруднюється ім. Тому значно більше поширення одержав гетерогенний каталіз.
По фазовій ознаці відомі різні види гетерогенного каталізу: рідкі каталізатори, що прискорюють реакції між рідинами, які не змішуються, (чи рідинами і газами) і тверді каталізатори, що прискорюють реакції між рідинами чи газами. Більшість каталітичних реакцій - це реакції газів за участю твердих каталізаторів. З існуючих теорій каталізу загальним для всіх теорій є утворення на поверхні твердого каталізатора проміжної сполуки адсорбційного типу за участю електронів каталізатору.
Каталізатори, як правило, являють собою пористі тверді тіла, що мають високорозвинену внутрішню поверхню. Весь каталітичний процес на твердому пористому каталізаторі можна представити у вигляді п'яти самостійних стадій:
1)Дифузія реагуючих речовин з потоку до поверхні зерна каталізатора й усередину пір, що маються в зерні.
2)Активована адсорбція (хемосорбція) на поверхні каталізатора з утворенням проміжних поверхневих сполук реагент - каталізатор.
3)Перегрупування атомів з утворенням проміжної сполуки продукт – каталізатор.
4)Десорбція продукту з поверхні каталізатора.
5)Дифузія продукту з поверхні каталізатора спочатку усередині пір, а потім з поверхні зерна в загальний потік.
Загальна швидкість сумарного каталітичного процесу лімітується самою повільною зі стадій. Якщо цією стадією є один з дифузійних етапів, то каталіз проходить у дифузійній області. Причому розрізняють зовні- і внутрідифузійні області. Якщо повільними є 2, 3 чи 4 стадія, то процес йде в кінетичній області.
Загальне рівняння швидкості каталітичного процесу, який протікає в кінетичній області,
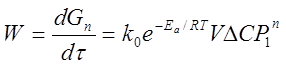 ,
,
де ![]() - збільшення кількості продукту в часі;
- збільшення кількості продукту в часі;
k0 – передекспонент у рівнянні Ареніусу;
V – насипний об'єм каталізатора;
ΔС – рушійна сила процесу при атмосферному тиску;
Р1 – безрозмірний тиск, тобто відношення дійсного тиску до атмосферного;
n – порядок реакції.
У кінетичній області протікають процеси на малоактивних каталізаторах із дрібними розмірами зерен і великих пір при турбулентному режимі потоку реагентів і невисоких температурах.
Якщо процес йде у зовнішньодифузійній області, то швидкість визначається коефіцієнтом дифузії реагентів і продуктів реакції. За законом Фіка
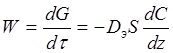 ,
,
де Dэ – ефективний коефіцієнт дифузії;
S – вільна поверхня зерен каталізатора;